Kardiolipin
| Kardiolipin | |||

| |||
| IUPAC-név | 1,3-bisz(sn-3’-foszfatidil)-sn-glicerin | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| DrugBank | DB03429 | ||
| KEGG | C05980 | ||
| ChEBI | 28494 | ||
| |||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A kardiolipin (IUPAC-név: 1,3-bisz(sn-3’-foszfatidil)-sn-glicerin, ahol az sn sztereospecifikus számozásra utal) a mitokondrium belső membránjának fontos része, ahol a lipidek mintegy 20%-át alkotja. Megtalálható a legtöbb baktérium membránjában is. A kardiolipin neve abból ered, hogy állati szívben találták meg először. 1942-ben izolálta először marhaszívből Mary C. Pangborn.[1] Az emlős- és növényi sejtekben[2][3] a kardiolipin (CL) szinte csak a mitokondriumok belső membránjában található, ahol számos, a mitokondriumok metabolizmusában résztvevő enzim funkciójában fontos.
Szerkezet[szerkesztés]

A kardiolipin (CL) difoszfatidilglicerin-lipid. Két foszfatidsav molekularész kapcsolódik benne glicerinközponthoz dimert alkotva, így 4 zsírsavcsoportja van legfeljebb 2 negatív töltéssel. Mivel 4 szénhidrogén kapcsolódik össze a kardiolipinben, a molekula számos módon összetevődhet, de a legtöbb állati szövetben a kardiolipin 18 szénatomos zsírsavláncokból áll két-két telítetlen kötéssel.[4] Feltehetően a (18:2)4 acilkonfiguráció fontos a CL membránfehérjékhez való kapcsolódásában az emlősmitokondriumok esetén.[5] Azonban az izolált enzimpreparátumos kísérletek szerint a fontossága a vizsgált fehérjétől függ.
Mivel 2 foszfát van a molekulában, mindegyikük protonálható. Bár szimmetrikus szerkezetűek, egy foszfát ionizálása eltérő savasságnál történik a másikénál: pK1 = 3, és pK2 > 7,5. Így fiziológiás körülmények közt (ahol a pH mintegy 7) a molekula 1 negatív töltéssel rendelkezik. A foszfát hidroxilcsoportjai (–OH and –O−) stabil intramolekuláris hidrogénkötést tudnak alkotni a glicerin hidroxilcsoportjával, kétgyűrűs rezonanciaszerkezetet adva. E szerkezet egy protont csapdáz, ami segíti az oxidatív foszforilációt.
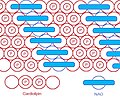
Mivel a fejcsoport kis kétgyűrűs szerkezetet alkot, területe kicsi a nagy, 4 acilcsoportos farokrégióhoz képest. E speciális szerkezet alapján a fluoreszcens mitokondriális indikátort, a nonilakridinnarancsot (NAO) 1982-ben bevezették,[6] és később kiderült, hogy CL-hez kötődve célozza a mitokondriumokat. Nagy a fej- és kicsi a farokcsoportja, szemben a kardiolipinnel, és igen rendezetten jelenik meg.[7] Több tanulmányt közöltek NAO-t kvantitatív mitokondriális indikátorként és CL-tartalom indikátoraként egyaránt használva. Azonban a NAO-t befolyásolja a CL membránpotenciálja vagy a térbeli elrendezése,[8][9][10] így nem megfelelő a NAO CL vagy mitokondriumok kvantitatív tanulmányozására, azonban továbbra is egyszerű CL-tartalom-vizsgálati eszköz.
-
Kardiolipinszerkezet
-
A NAO szerkezete
-
NAO és CL elrendeződése
Kardiolipin mérése és észlelése[szerkesztés]
A CL-speciesek észlelése, mérése és elhelyezése hasznos a számos betegséget okozó mitokondriális diszfunkció és a patofiziológiai mechanizmusok vizsgálatára. A CL-t folyadékkromatográfiával mérik, gyakran tömegspektrometriával, tömegspektrometria-képalkotással, lipidomikával, ionmobilitás-spektrometriával, fluorometriával és radioaktív jelöléssel együtt.[11] Így az analitikai módszer a kísérlet kérdésétől, a részletességtől és a szükséges pontosságtól függ.
Metabolizmus és katabolizmus[szerkesztés]

Metabolizmus[szerkesztés]
Eukariótákban[szerkesztés]
Eukariótákban, például gombákban, növényekben és állatokban a szintézis feltehetően mitokondriumokban történik. Az első lépés a glicerin-3-foszfát glicerin 3-foszfáttal történő acilezése (aciltranszferáz). Ezután az acilglicerin-3-foszfát ismét acilezhető foszfatidsavat (PA) alkotva. A CDP-DAG-szintáz (CDS, foszfatidát-citidililtranszferáz) segítségével a PA citidindifoszfát-diacilglicerinné (CDP-DAG) alakul. Ezután a CDP-DAG foszfatidilglicerin-foszfáttá (PGP) alakul a PGP-szintáz révén, ezt defoszforilálja a PTPMT1 [12] PG-t alkotva. Végül egy CDP-DAG-molekula kötődik a PG-hez 1 kardiolipinmolekulát alkotva, e reakciót a kardiolipin-szintáz (CLS) katalizálja.[2][3][13]
Prokariótákban[szerkesztés]
Prokariótákban a difoszfatidilglicerin-szintáz egy foszfatidilglicerin foszfatidilcsoportját egy másik 3’-hidroxilcsoportjára viszi át 1 glicerinmolekula eliminációjával foszfolipáz D-hez hasonló enzimmel. Az enzim adott körülmények közt fordítva is tud működni kardiolipin eltávolítására.
Katabolizmus[szerkesztés]
A kardiolipin katabolizmusa a foszfolipáz A2 katalízisével történhet acilcsoportok eltávolításával. A foszfolipáz D (PLD) hidrolizálja a kardiolipint foszfatidsavvá.[14]
Funkciók[szerkesztés]
Aggregátumok szabályzása[szerkesztés]

A kardiolipin egyedi szerkezete miatt a pH-változás és a kétértékű kationok jelenléte szerkezeti változást okozhat. A CL számos aggregátumformával rendelkezik. Ca2+ vagy más kétértékű kationok jelenlétében a CL lamelláris-hexagonális (La-HII) állapotváltozása indukálható, ez feltehetően közeli kapcsolatban van a membránfúzióval.[15]
Negyedleges szerkezet fenntartása[szerkesztés]
A citokróm c-oxidáz mitokondriumokban és baktériumokban található nagy transzmembrán fehérjekomplex. Ez a légzési elektrontranszport utolsó enzime a belső mitokondriális vagy bakteriális membránban. 1 elektront vesz fel 4 citokróm c-molekulától, és 1 oxigénhez adja le, így azt 2 vízmolekulává alakítja. A teljes enzimműködéséhez 2 CL-molekula kell. A citokróm bc1 (komplex III) is kardiolipint igényel negyedleges szerkezete és működése fenntartásához.[16] Az oxidatív foszforilációban résztvevő komplex V is CL-kötő affinitása is nagy – egy molekulája 4 CL-molekulához kapcsolódik.[17]
Apoptózis elindítása[szerkesztés]

A kardiolipin külső mitokondriális membránba kerülése apoptózishoz vezet, ahogy azt a citokróm c-felszabadulás, a kaszpáz 8 aktiválása, a MOMP indukció és az NLRP3 inflammaszóma aktiválása is megmutatja.[18] Az apoptózis során a cyt c a mitokondrium membránközi részeiből a citoszolba kerül. Ezután az az endoplazmatikus retikulum IP3 receptorához kapcsolódhat, a kalciumfelszabadulást stimulálva, további cyt c-felszabadulást okozva. Ha a kalciumkoncentráció tocikus szintet ér el, ez sejthalált okoz. A cyt c feltehetően az apoptózisban is szerepet játszhat apoptotikus faktorok mitokondriumokból való felszabadításával.[19] Egy kardiolipinspecifikus oxigenáz CL-hidroperoxidokat hoz létre, lehetővé téve a lipid konformációjának változását. Az oxidált CL a belső membránból a külsőbe megy, és segíti a permeábilis pórus létrehozását, ahol kijöhet a cyt c.
Protoncsapda oxidatív foszforilációhoz[szerkesztés]

A komplex IV katalizálta oxidatív foszforiláció során sok proton megy a membrán egyik oldaláról a másikra, nagymértékű pH-változást okozva. A CL feltehetően protoncsapda a mitokondriális membránokban, helyhez kötve a protonokat, csökkentve a pH-változást a mitokondriummembránok közt.
Ennek oka a CL egyedi szerkezete. Ahogy fent szerepel, a CL kétgyűrűs szerkezetben képes befogni protont negatív töltés hordozása mellett, így e kétgyűrűs szerkezet elektronpufferként működhet protonok elnyelésére vagy felszabadítására a pH fenntartására.[7]
Egyéb funkciók[szerkesztés]
- Koleszterintranszlokáció a külsőből a belső mitokondriummembrán felé.
- Mitokondriális koleszterinoldallánc-leválasztás aktiválása
- Fehérje mitokondriális mátrixba helyezése
- Antikoaguláns
- α-szinuklein modulációja[20] – feltehetően ennek hibás működése okozza a Parkinson-kórt.
Klinikai jelentősége[szerkesztés]
Több bizonyíték kapcsolja össze a hibás CL-metabolizmust és -összetételt humán betegségekhez, például neurológiai, szív- és érrendszeri vagy anyagcserezavarokhoz vagy rákhoz.[11] A CL-zavarok okozta betegségek növekedése révén a kvalitatív és kvantitatív diagnózisok használata szükségessé vált.
Anyagcserezavarok[szerkesztés]
Barth-szindróma[szerkesztés]
A Barth-szindróma az 1970-es években felfedezett, gyermekkori halált okozó ritka genetikai betegség. Egy kardiolipint előállító enzimet, a tafazzint kódoló gén mutációja jellemzi. A tafazzin nélkülözhetetlen enzim az eukarióták kardiolipinszintézisében, mivel a CL acilláncait alakítja át a linolsav PC-ről monolizokardiolipinre való áthelyezésével.[21] A tafazzin mutációja elégtelen kardiolipin-átrendezéssel jár, de feltehetően a sejtek kompenzálnak, és ATP-termelésük hasonló vagy nagyobb a normál sejtekénél.[22] A heterozigóta nők érintetlenek. Az érintett betegekben gyakori a kardiomiopátia és az általános gyengeség.
Kombinált malon- és metilmalonaciduria (CMAMMA)[szerkesztés]
Az ACSF3-hiány miatti kombinált malon- és metilmalonaciduriára (CMAMMA) megváltozott komplexlipid-összetétel jellemző a megváltozott mitokondriális zsírsavszintézis (mtFAS) miatt: például a kardiolipin-mennyiség sokkal nagyobb.[23][24]
Tangier-kór[szerkesztés]
A Tangier-kór is összefüggésben áll a CL-eltérésekkel. A Tangier-kór jellemzői az alacsony plazma-HDL-szint, a koleszterilészterek felhalmozódása szövetekben és a szív- és érrendszeri betegségek kockázatának növekedése.[25] A Barth-szindrómával szemben a Tangier-kór fő oka a rendkívül megnövekedett CL-termelés. Tanulmányok szerint 3-5-ször akkora a CL-szint Tangier-kór esetén.[26] Mivel a nagyobb CL-szintek a koleszterinoxidációt, az oxiszterolok keletkezése a koleszterinkiáramlást növelik, e folyamat a fölös koleszterin eltávolítására szolgálhat.
Parkinson- és Alzheimer-kór[szerkesztés]
Az oxidatív stressz és a lipidperoxidáció feltehetően a feketeállomány neuronveszteségének és mitokondriális diszfunkciójának oka lehet a Parkinson-kórban, és az Alzheimer-kór kialakulásának korai szakaszában is szerepe lehet.[27][28] Beszámolók szerint az agy CL-tartalma az idő előrehaladtával csökken,[29] és egy patkányagyakról szóló kísérlet szerint ez a szabadgyök-stressznek kitett mitokondriumokban történő lipidperoxidáció következménye. Egy másik tanulmány szerint a CL-bioszintézis szelektíven sérülhet, 20%-os csökkenést és összetétel-változást okozva a CL-tartalomban.[30] Ezenkívül a komplex I/III-aktivitás 15%-os csökkenésével is összefüggésben állhat, melyet a Parkinson-kór fontos tényezőjének tekintenek.[31]
Nem alkoholos zsírmáj és szívelégtelenség[szerkesztés]
2007-ben beszámoltak arról, hogy nem alkoholos zsírmáj[32] és szívelégtelenség esetén[33] a csökkent CL-szintek és a megváltozott acillánc-összetétel is megjelenik a mitokondriális diszfunkcióban, azonban a CL öregedésben és iszkémia-reperfúzióban játszott szerepe vitatott.
Cukorbetegség[szerkesztés]
A szívbetegség cukorbetegekben kétszer gyakoribb. Bennük a szív- és érrendszeri betegségek hamarabb kialakulnak, és gyakran vezetnek korai halálhoz. A cukorbetegség legkorábbi szakaszában kardiolipinmennyiség-csökkenést mutatott ki egy 2007-es tanulmány, feltehetően egy lipidemésztő enzim aktívabbá válása miatt.[34]
Szifilisz[szerkesztés]
A tehénszív kardiolipinje használatos antigénként a Wassermann-tesztben szifiliszre. Az antikardiolipin antitestek sok más esetben, például szisztémás lupus erythematosus, malária és tuberkulózis esetén is megjelenhetnek, így e teszt nem specifikus.
HIV-1[szerkesztés]
A humán immunhiányvírus-1 (HIV-1) több mint 60 millió embert fertőzött meg. A HIV-1 glikoproteinje legalább 4 antitest-semlegesítő helyet tartalmaz. E helyeken a membránproximális régió (MPR) különösen fontos antitestcélpont, mivel megkönnyíti a vírus T-sejtekbe jutását, és a vírustörzsek közt nagymértékben változatlan.[35] Azonban kiderült, hogy a 2F5 és 4E10 elleni antitestek reagálnak az autoantigénekkel, így a kardiolipinnel. Így nehéz ilyen antitesteket tartalmazó vakcinák fejlesztése.[36]
Rák[szerkesztés]
Először Otto Heinrich Warburg feltételezte, hogy a rák a mitokondriális anyagcsere hibájának következménye, de ennek szerkezeti alapja ismeretlen maradt. Mivel a kardiolipin fontos foszfolipid, mely szinte kizárólag a mitokondrium belső membránjában van, és a mitokondriális funkció fenntartásában fontos, feltehetően a CL eltérései sérthetik a mitokondriális funkciót és a bioenergetikát. Egy egéragytumorokról szóló, Warburg rákelméletét alátámasztó 2008-as tanulmány[37] a CL-tartalom vagy összetétel jelentős eltérését mutat a tumorokon belül.
Antifoszfolipid szindróma[szerkesztés]
Az antikardiolipin antitesttel (antifoszfolipid szindróma) rendelkező betegekben ismétlődő trombózis jelentkezhet akár 13 éves kortól, akár olyan erekben is, ahol viszonylag ritka a trombózis, például a máj és a vese ereiben. Ezen antitestek általában ismétlődő vetéléssel élő fiatal nőkben jelennek meg. Az antikardiolipin-mediált autoimmun betegségekben a felismerés apolipoprotein H-függő.[38]
További antikardiolipin betegségek[szerkesztés]
Bartonella-fertőzés[szerkesztés]
A bartonellózis macskák és emberek súlyos baktériumfertőzése. Spinella észrevette, hogy egy Bartonella henselaes beteg antikardiolipin antitesttel rendelkezett, ez alapján a Bartonella okozhatja feltehetően a termelésüket.[39]
Krónikusfáradtság-szindróma[szerkesztés]
A krónikusfáradtság-szindróma gyakran vírusfertőzés utáni idiopátiás betegség. Egy tanulmány szerint a CFS-betegek 95%-ának vannak antikardiolipin antitesteik.[40]
Jegyzetek[szerkesztés]
- ↑ Pangborn M. (1942). „Isolation and purification of a serologically active phospholipid from beef heart”. J. Biol. Chem. 143, 247–256. o. DOI:10.1016/S0021-9258(18)72683-5.
- ↑ a b (2005) „Cardiolipin synthase of Arabidopsis thaliana”. FEBS Letters 579 (10), 2161–2165. o. DOI:10.1016/j.febslet.2005.03.007. PMID 15811335.
- ↑ a b M. Nowicki (2006). „Characterization of the Cardiolipin Synthase from Arabidopsis thaliana”. Ph.D. Thesis, RWTH-Aachen University. (Hozzáférés: 2011. július 11.)
- ↑ (1993. március 1.) „Mitochondrial cardiolipin in diverse eukaryotes”. European Journal of Biochemistry 212 (3), 727–733. o. DOI:10.1111/j.1432-1033.1993.tb17711.x. PMID 8385010. [halott link]
- ↑ (1994) „Relationship between lipid saturation and lipid-protein interaction in liver mitochondria modified by catalytic hydrogenation with reference to cardiolipin molecular species”. Biochem. J. 265 (1), 79–85. o. DOI:10.1042/bj2650079. PMID 2154183.
- ↑ (1982) „The fluorescent staining of mitochondria in living HeLa- and LM-cells with new acridine dyes”. Histochemistry 74 (1), 1–7. o. DOI:10.1007/BF00495046. PMID 7085344.
- ↑ a b (2002) „Cardiolipin: a proton trap for oxidative phosphorylation”. FEBS Lett. 528 (1–3), 35–39. o. DOI:10.1016/S0014-5793(02)03292-1. PMID 12297275.
- ↑ (2004) „Use of the fluorescent dye 10-N-nonyl acridine orange in quantitative and location assays of cardiolipin: a study on different experimental models”. Analytical Biochemistry 328 (2), 174–180. o. DOI:10.1016/j.ab.2004.01.020. PMID 15113694.
- ↑ (2002) „Intracellular distribution of the fluorescent dye nonyl acridine orange responds to the mitochondrial membrane potential: implications for assays of cardiolipin and mitochondrial”. Mass. J Neurochem 82 (2), 224–233. o. DOI:10.1046/j.1471-4159.2002.00945.x. PMID 12124423.
- ↑ (2000) „Staining of mitochondrial membranes with 10-nonyl acridine orange, MitoFluor Green, and Mito-Tracker Green is affected by mitochondrial membrane potential altering drugs”. Cytometry 39 (3), 203–210. o. DOI:<203::AID-CYTO5>3.0.CO;2-Z 10.1002/(SICI)1097-0320(20000301)39:3<203::AID-CYTO5>3.0.CO;2-Z. PMID 10685077.
- ↑ a b (2022. december 1.) „Advances in methods to analyse cardiolipin and their clinical applications” (angol nyelven). TrAC Trends in Analytical Chemistry 157, 116808. o. DOI:10.1016/j.trac.2022.116808. ISSN 0165-9936. PMID 36751553.
- ↑ Zhang, J (2011. június 8.). „Mitochondrial phosphatase PTPMT1 is essential for cardiolipin biosynthesis”. Cell Metab 13 (6), 690–700. o. DOI:10.1016/j.cmet.2011.04.007. PMID 21641550. (Hozzáférés: 2011. november 8.)
- ↑ (2008) „Cardiolipin, the heart of mitochondrial metabolism”. Cell. Mol. Life Sci. 65 (16), 2493–2506. o. DOI:10.1007/s00018-008-8030-5. PMID 18425414.
- ↑ Gregor Cevc. Phospholipids handbook. CRC Press, 783. o. (1993. augusztus 2.). ISBN 978-0-8247-9050-9
- ↑ (1999) „Membrane fusion and the lamellar-to-inverted-hexagonal phase transition in cardiolipin vesicle systems induced by divalent cations”. Biophysical Journal 77 (4), 2003–2014. o. DOI:10.1016/S0006-3495(99)77041-4. PMID 10512820.
- ↑ (1999) „Phospholipase Digestion of Bound Cardiolipin Reversibly Inactivates Bovine Cytochrome bc1”. Biochemistry 38 (28), 9031–9038. o. DOI:10.1021/bi990603r. PMID 10413476.
- ↑ (1990) „Tightly associated cardiolipin in the bovine heart mitochondrial ATP synthase as analyzed by 31P nuclear magnetic resonance spectroscopy”. J. Biol. Chem. 265 (32), 19434–19440. o. DOI:10.1016/S0021-9258(17)45391-9. PMID 2147180.
- ↑ (2009) „Role of cardiolipin peroxidation and Ca2+ in mitochondrial dysfunction and disease”. Cell Calcium 45 (6), 643–650. o. DOI:10.1016/j.ceca.2009.03.012. PMID 19368971.
- ↑ Natalia A. Belikova (2006). „Peroxidase Activity and Structural Transitions of Cytochrome c Bound to Cardiolipin-Containing Membranes”. Biochemistry 45 (15), 4998–5009. o. DOI:10.1021/bi0525573. PMID 16605268.
- ↑ (2018. február 26.) „Cardiolipin exposure on the outer mitochondrial membrane modulates α-synuclein” (angol nyelven). Nature Communications 9 (1), 817. o. DOI:10.1038/s41467-018-03241-9. ISSN 2041-1723. PMID 29483518.
- ↑ (2006) „The enzymatic function of tafazzin”. J. Biol. Chem. 281, 39217–39224. o. DOI:10.1074/jbc.M606100200. PMID 17082194.
- ↑ (2013) „Barth syndrome: Cellular compensation of mitochondrial dysfunction and apoptosis inhibition due to changes in cardiolipin remodeling linked to tafazzin (TAZ) gene mutation”. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease 1832 (8), 1194–1206. o. DOI:10.1016/j.bbadis.2013.03.005. PMID 23523468.
- ↑ (2019. november 1.) „The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism” (angol nyelven). Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids 1864 (11), 1629–1643. o. DOI:10.1016/j.bbalip.2019.07.012. ISSN 1388-1981. PMID 31376476.
- ↑ Tucci, Sara (2020. január 22.). „Brain metabolism and neurological symptoms in combined malonic and methylmalonic aciduria”. Orphanet Journal of Rare Diseases 15 (1), 27. o. DOI:10.1186/s13023-020-1299-7. ISSN 1750-1172. PMID 31969167.
- ↑ Oram J. F. (2000). „Tangier disease and ABCA1”. Biochim. Biophys. Acta 1529 (1–3), 321–330. o. DOI:10.1016/S1388-1981(00)00157-8. PMID 11111099.
- ↑ (2001) „Accumulation of cardiolipin and lysocardiolipin in fibroblasts from Tangier disease subjects”. FEBS Lett. 500 (3), 157–162. o. DOI:10.1016/S0014-5793(01)02578-9. PMID 11445077.
- ↑ Beal M.F. (2003). „Mitochondria, oxidative damage, and inflammation in Parkinson's disease”. Ann NY Acad Sci 991 (1), 120–131. o. DOI:10.1111/j.1749-6632.2003.tb07470.x. PMID 12846981.
- ↑ Jenner P. (1991). „Oxidative stress as a cause of Parkinson's disease”. Acta Neurol Scand Suppl 136, 6–15. o. DOI:10.1002/ana.10483. PMID 12666096.
- ↑ (1991) „Lipid composition in synaptic and nonsynaptic mitochondria from rat brains and effect of aging”. J Neurochem 59 (2), 487–491. o. DOI:10.1111/j.1471-4159.1992.tb09396.x. PMID 1629722.
- ↑ (2005) „Mitochondrial Lipid Abnormality and Electron Transport Chain Impairment in Mice Lacking α-Synuclein”. Mol Cell Biol 25 (22), 10190–10201. o. DOI:10.1128/MCB.25.22.10190-10201.2005. PMID 16260631.
- ↑ (2003) „Molecular pathways of neurodegeneration in Parkinson's disease”. Science 302 (5646), 819–822. o. DOI:10.1126/science.1087753. PMID 14593166.
- ↑ (2007) „Mitochondrial dysfunction in rat with nonalcoholic fatty liver: involvement of complex I, reactive oxygen species and cardiolipin”. Biochim. Biophys. Acta 1767 (10), 1260–1267. o. DOI:10.1016/j.bbabio.2007.07.011. PMID 17900521.
- ↑ (2007) „Loss of cardiac tetralinoleoyl cardiolipin in human and experimental heart failure”. J. Lipid Res. 48 (7), 1559–1570. o. DOI:10.1194/jlr.M600551-JLR200. PMID 17426348.
- ↑ Xianlin Han (2007). „Alterations in Myocardial Cardiolipin Content and Composition Occur at the Very Earliest Stages of Diabetes: A Shotgun Lipidomics Study”. Biochemistry 46 (21), 6417–6428. o. DOI:10.1021/bi7004015. PMID 17487985.
- ↑ Gary J. Nabel (2005). „Immunology: Close to the Edge: Neutralizing the HIV-1 Envelope”. Science 308 (5730), 1878–1879. o. DOI:10.1126/science.1114854. PMID 15976295.
- ↑ J. M. Binley (2004). „Comprehensive Cross-Clade Neutralization Analysis of a Panel of Anti-Human Immunodeficiency Virus Type 1 Monoclonal Antibodies”. J. Virol. 78 (23), 13232–13252. o. DOI:10.1128/JVI.78.23.13232-13252.2004. PMID 15542675.
- ↑ Michael A. Kiebish (2008). „Cardiolipin and electron transport chain abnormalities in mouse brain tumor mitochondria: lipidomic evidence supporting the Warburg theory of cancer”. Journal of Lipid Research 49 (12), 2545–2556. o. DOI:10.1194/jlr.M800319-JLR200. PMID 18703489.
- ↑ (1990) „Anti-phospholipid antibodies are directed against a complex antigen that includes a lipid-binding inhibitor of coagulation: beta 2-glycoprotein I (apolipoprotein H)”. Proc. Natl. Acad. Sci. U.S.A. 87 (11), 4120–4124. o. DOI:10.1073/pnas.87.11.4120. PMID 2349221.
- ↑ Spinella A, Lumetti F, Sandri G, Cestelli V, Mascia MT. Beyond cat scratch disease: a case report of bartonella infection mimicking vasculitic disorder. Case Rep Infect Dis. 2012;2012:354625.
- ↑ Hokama Y, Campora CE, Hara C, Kuribayashi T, Le Huynh D, Yabusaki K. Anticardiolipin antibodies in the sera of patients with diagnosed chronic fatigue syndrome. J Clin Lab Anal. 2009;23(4):210-2.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Cardiolipin című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
- Cardiolipin a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
- Cardiolipin (Diphosphatidylglycerol)