Foszfid

A foszfid P3− iont vagy ennek megfelelőjét tartalmazó vegyület. Számos különböző szerkezetű foszfid ismert.[1] Leggyakoribbak a biner foszfidok, vagyis a foszfor és egy elektropozitívabb elem vegyületei. Ismertek polifoszfidok is anionos foszforlánccal vagy -klaszterrel. A Hg, az Sb, a Bi és a Po kivételével a legtöbb elektropozitívabb elemnek ismert foszfidja.[2] Egyes foszfidok molekulárisak.
Biner foszfidok[szerkesztés]
A biner foszfidokban foszfor és egy más elem van. Alkálifém-foszfid például a nátrium-foszfid (Na3P). További biner foszfidok a mérgező foszfin hidrolíziskor történő kibocsátása miatt kártevőirtóként használt alumínium-foszfid (AlP) és a kalcium-foszfid (Ca3P2). A magnézium-foszfid (Mg3P2) is érzékeny a nefvességre. Az indium- (InP) és a gallium-foszfid (GaP) félvezetőként használatosak, gyakran a megfelelő arzenidekkel együtt.[3] A réz-foszfid (Cu3P) különleges sztöchiometriájú foszfid. Ezek oldhatatlan 3 dimenziós polimerek. Az elektropozitív fémek foszfidjai hidrolizálnak:

Polifoszfidok[szerkesztés]
A polifoszfidok P–P kötést tartalmaznak. A legegyszerűbbek P4−2 iont tartalmaznak, mások például P3−11 vagy polimeraniont (például a helikális (P− )n iont) vagy komplex lapos vagy 4 dimenziós aniont.[4] Számos szerkezet ismert. A káliumnak 9 foszfidja ismert: K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11, KP10,3 és KP15. A nikkelnek 8 mono- és polifoszfidja ismert, ezek képlete Ni3P, Ni5P2, Ni12P5, Ni2P, Ni5P4, NiP, NiP2 és NiP3.[2]
Két polifoszfid, a K4P3-ban lévő P4−3 és a K5P4-ben lévő P5−4 gyökanionok páratlan számú vegyértékelektronnal, így mindkét vegyület paramágneses.[2]
Foszfidok és polifoszfidok előállítása[szerkesztés]
Sokféleképp állíthatók elő foszfidok. Gyakran fém és vörösfoszfor hevítésével állítják elő inert környezetben vagy vákuumban. Elvben minden fém-foszfid és -polifoszfid előállítható elemi foszforból és a megfelelő fémből sztöchiometrikus formában. Azonban a szintézist számos gond nehezíti. Az exoterm reakciók gyakran robbanásszerűek a helyi túlmelegedés miatt. Az oxidált fém vagy a fém külsején lévő oxidréteg a foszforozáshoz túl magas hőmérsékletet okoz.[5] A nikkel-foszfid-előállításhoz használt hidrotermális reakciók tiszta és jól kristályosodó nikkel-foszfidokat (Ni2P és Ni12P5) adtak. E vegyületek NiCl2·12 H2O és vörösfoszfor reakciójával állíthatók elő 200 °C-on 24, illetve 48 óra alatt.[6]
Fém-foszfidok állíthatók elő trisz(trimetilszilil)foszfin fém-halogenidekkel való reakciójában. Ebben a reakcióban a halogenid illékony klór-trimetilszilánban távozik.
Molekuláris foszfidok[szerkesztés]
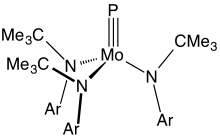
A fém–foszfor hármas kötést tartalmazó vegyületek ritkák. A leggyakoribb példák képlete PMo(NR2)3, ahol R nagy szerves csoport.[7]
K2P16 vörösfoszforból és kálium-etoxidból való előállításáról is beszámoltak.[8]
Szerves foszfidok[szerkesztés]
Számos szerves foszfid ismert. Gyakoriak a R2PM képletűek, ahol R szerves szubsztituens, M fém. Erre példa a lítium-difenilfoszfid. A Zintl-klaszter (P3−7) számos alkálifém-vegyületből megkapható.
A természetben[szerkesztés]
A schreibersit ((Fe,Ni)3P) gyakori egyes meteoritokban
Jegyzetek[szerkesztés]
- ↑ Chemistry of the Elements, 2nd, Butterworth-Heinemann (1997). ISBN 978-0-08-037941-8
- ↑ a b c Von Schnering, H. G., Hönle, W..szerk.: R. Bruce King: Phosphides - Solid-state Chemistry, {{{title}}}. John Wiley & Sons (1994). ISBN 0-471-93620-0
- ↑ (2003) „Chemical vapour deposition of group Vb metal phosphide thin films”. Journal of Materials Chemistry 13 (8), 1930. o. DOI:10.1039/b304084b.
- ↑ (1987) „Phosphides and Polyphosphides of the Transition Metals”. Phosphorus and Sulfur and the Related Elements 30 (1–2), 413–416. o. DOI:10.1080/03086648708080608.
- ↑ (1988) „Bridging Chasms with Phosphides”. Chemical Reviews 88, 243–273. o. DOI:10.1021/cr00083a012.
- ↑ (2010) „A simple mild hydrothermal route for the synthesis of nickel phosphide powders”. Ceramics International 36 (3), 1155–1158. o. DOI:10.1016/j.ceramint.2009.12.015.
- ↑ (2010) „Early-Transition-Metal-Mediated Activation and Transformation of White Phosphorus”. Chemical Reviews 110 (7), 4164–77. o. DOI:10.1021/cr9003709. PMID 20175534.
- ↑ (2016. március 14.) „Facile Conversion of Red Phosphorus into Soluble Polyphosphide Anions by Reaction with Potassium Ethoxide”. Angewandte Chemie International Edition 55 (12), 3904–3908. o. DOI:10.1002/anie.201511186. PMID 26928980.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Phosphide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

