Xenon-tetroxid
| Xenon-tetroxid | |
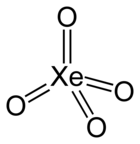 Xenon-tetroxid |
 A xenon-tetroxid molekula térbeli szerkezetének a modellje |
| IUPAC-név | xenon-tetraoxid xenon(VIII)-oxid |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 12340-14-6 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | XeO4 |
| Moláris tömeg | 195,29 g mol−1 |
| Megjelenés | −36 °C alatt sárga színű, szilárd |
| Sűrűség | ? g cm−3, szilárd |
| Olvadáspont | −35,9 °C |
| Forráspont | 0 °C[1] |
| Kristályszerkezet | |
| Molekulaforma | tetraéderes[2] |
| Dipólusmomentum | 0 D |
| Termokémia | |
| Std. képződési entalpia ΔfH |
? kJ·mol−1 |
| Standard moláris entrópia S |
? J·K−1·mol−1 |
| Veszélyek | |
| EU osztályozás | Explozív (E) |
| Rokon vegyületek | |
| Rokon vegyületek | Perxenonsav Xenon-trioxid |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A xenon-tetroxid az oxigén és a xenon kémiai vegyülete, képlete XeO4, és arról nevezetes, hogy a nemesgázokat tartalmazó vegyületek között stabilnak számít. Sárga, kristályos, szilárd anyag. −35,9 °C alatt stabil, fölötte robbanékony, xenonra és oxigénre (O2) esik szét.[3][4]
A xenonnak mind a nyolc vegyértékelektronja részt vesz az oxigénnel alkotott kémiai kötésben. A xenon atom oxidációs száma +8. Az oxigén az egyetlen elem, mely a xenont a legmagasabb oxidációs állapotba tudja vinni, még a fluor is – valószínűleg sztérikus okok miatt – csak XeF6-ot képez.
Kémiai reakciók[szerkesztés]
−35,9 °C hőmérséklet fölött spontán robbanás következik be, ahol ΔH = −643 kJ/mol.
- XeO4 → Xe + 2 O2
A másik két rövid életű +8 oxidációs számú xenonvegyület a xenon-tetroxid és a xenon-hexafluorid kölcsönhatásának eredményeképp jön létre. A XeO3F2 és a XeO2F4 a tömegspektrometria segítségével mutatható ki.
Előállítása[szerkesztés]
Minden szintézis a perxenátokból indul ki, melyek a xenátokból kétféleképp állíthatók elő. Az egyik eljárás az, mikor a xenát perxenátra és xenonra diszproporcionálódik:
- 2 XeO42− → XeO4−6 + Xe + O2.
A másik folyamatban a xenátokat ózonnal oxidálják:
- 2 XeO42− + 4 e− + 2 O3 → 2 XeO4−6 + 2 O2.
A bárium-perxenátot kénsavval reagáltatják, és a bomlékony perxenonsav dehidratálásával xenon-tetroxidot állítanak elő:
- Ba2XeO6 + 2 H2SO4 → 2 BaSO4 + (H4XeO6 → 2 H2O + XeO4).
Az instabil perxenonsav lassan olyan lebomláson megy keresztül, melynek a végén xenonsav és oxigén jön létre:
- H4XeO6 → 1/2 O2 + H2XeO4 + H2O.
Lásd még[szerkesztés]
Jegyzetek[szerkesztés]
- ↑ Lide, David R. (1998). „Handbook of Chemistry and Physics”, 494. o, Kiadó: CRC Press.
- ↑ G. Gundersen, K. Hedberg, J. L.Huston (1970). „Molecular Structure of Xenon Tetroxide, XeO4”. J. Chem. Phys. 52, 812–815. o. DOI:10.1063/1.1673060.
- ↑ H.Selig , J. G. Malm , H. H. Claassen , C. L. Chernick , J. L. Huston (1964). „Xenon tetroxide -Preparation + Some Properties”. Science 143, 1322. o. DOI:10.1126/science.143.3612.1322. PMID 17799234.
- ↑ J. L. Huston, M. H. Studier, E.N. Sloth (1964). „Xenon tetroxide - Mass Spectrum”. Science 143, 1162. o. DOI:10.1126/science.143.3611.1161-a. PMID 17833897.
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben a xenon tetroxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források[szerkesztés]
- szerk.: Lide, D. R.: CRC Handbook of Chemistry and Physics, 83rd, Boca Raton, FL: CRC Press (2002. április 16.). ISBN 0-8493-0483-0
