Walden-inverzió
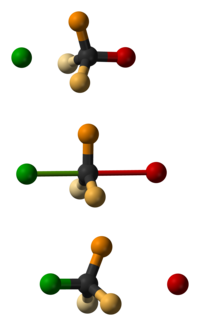
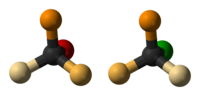
A Walden-inverzió[1] (vagy Walden-féle inverzió[2]) egy molekula kiralitáscentrumának kémiai reakció közben történő inverziója. Mivel egy kiralitáscentrumra nézve egy molekulának két enantiomerje létezhet, a Walden-inverzió során a molekula konfigurációja az egyik enantiomerből a másikba alakul át. Például az SN2 reakcióban a tetraéderes szénatomon Walden-inverzió történik. Szemléltetésként képzeljünk el egy esernyőt, amelyet a szélvihar kifordít. Az SN2 reakcióban a nukleofil hátoldali támadása miatt olyan termék keletkezik, amelynek konfigurációja a reaktánséval ellentétes. Emiatt az SN2 reakció a termék 100%-os inverziójával jár együtt, ezt nevezik Walden-inverziónak.
A jelenséget elsőként Paul Walden figyelte meg 1896-ban. Az úgynevezett Walden-ciklusban oda-vissza át tudta alakítani egy vegyület egyik enantiomerjét a másikba: a (+)-klórborostyánsavat (1) – a konfiguráció megtartása (retenció) mellett – vízben ezüst(I)-oxiddal (+)-almasavvá (2) alakította, majd a következő lépésben – foszfor-pentakloriddal – a hidroxilcsoportot klórral helyettesítve a klórborostyánkősav másik enantiomerjét nyerte (3). Újabb ezüst-oxidos reakcióval (−)-almasavat (4) kapott, melyből végül a második PCl5-ös reakcióval megkapta a kiindulási anyagot.[3]
Ebben a reakcióban az első lépésben használt ezüst-oxid hidroxiddonor, az ezüstion nem játszik szerepet a reakcióban. A reakció köztitermékei az A karboxil-dianion, melyből a β-karboxilátnál történő intramolekuláris nukleofil szubsztitúcióval négytagú gyűrűs β-lakton (B) keletkezik. Az α-karboxilcsoport is reakcióképes, de in silico adatok alapján a háromtagú α-laktongyűrűnek túl magasan fekszik az átmeneti állapota. A hidroxidion hatására felnyílik a laktongyűrű és a C alkohol keletkezik, a kétszeres inverzió eredményeként pedig megmarad az eredeti konfiguráció (retenció).[4]
Jegyzetek
[szerkesztés]- ↑ 3.1.4 Szubsztitúció telített szénatomon. In Kémia. Főszerk. Náray-Szabó Gábor. Budapest: Akadémiai. 2006. 433. o. = Akadémiai kézikönyvek, ISBN 963 05 8240 6 Hozzáférés: 2021. április 3.
- ↑ Römpp vegyészeti lexikon: Negyedik kötet Q–Zs. Szerk. Otto-Albrecht Neumüller–a magyar kiad. főszerk. Polinszky Károly. A 7. német kiadás alapján készült kiegészített magyar kiadás. Budapest: Műszaki Könyvkiadó. 1984. 985. o. ISBN 963 10 4749 0
- ↑ P. Walden (1896). „Ueber die gegenseitige Umwandlung optischer Antipoden”. Berichte der deutschen chemischen Gesellschaft 29 (1), 133–138. o. DOI:10.1002/cber.18960290127.
- ↑ The Walden cycle revisited: a computational study of competitive ring closure to α- and -lactones J. Grant Buchanan, Richard A. Diggle, Giuseppe D. Ruggiero and Ian H. Williams Chemical Communications, 2006, 1106 - 1108 Abstract.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Walden inversion című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

