Terminális dezoxinukleotidiltranszferáz
| Terminális dezoxinukleotidiltranszferáz | |
| Azonosítók | |
| Jel | DNTT, TDT |
| Entrez | 1791 |
| OMIM | 187410 |
| RefSeq | NM_001017520 |
| UniProt | P04053 |
| PDB | 2COE |
| Egyéb adatok | |
| Lokusz | 10. krom. q24.1 |
A terminális dezoxinukleotidiltranszferáz (TdT), más néven DNS-nukleotidilexotranszferáz (DNTT) vagy terminális tarnszferáz speciális DNS-polimeráz, melyet éretlen, pre-B és pre-T limfoid szövetek és akut limfoblasztos leukémia/limfómasejtek expresszálnak. A TdT N-nukleotidokat ad hozzá a TCR és BCR gének V, D és J exonjaihoz az antitestgén-rekombináció során, lehetővé téve a kapcsolati diverzitást. A DNTT gén kódolja.[1][2] A DNS-polimerázok X-családjának tagjaként az ugyanide tartozó DNS-polimeráz λ-val és μ-vel együtt működik. A TdT okozta diverzitás a gerincesek immunitásának fejlődésében fontos, jelentősen növelve a sejtek patogének ellen használható antigénreceptorainak számát. A TdT-knockout egerekben mintegy tizedakkora a T-sejt-receptor- (TCR) diverzitás, mint a vad típusúakban. A nagyobb TCR-diverzitás nagyobb fertőzés-ellenállást okoz.[3][4] Bár a TdT volt az egyik első emlősökben azonosított DNS-polimeráz (1960-ban fedezték fel),[5] az egyik legkevésbé ismert közülük.[3] 2016–18 közt felfedezték, hogy in trans templátdependens aktivitása is van az ismertebb templátindependens mellett.[6][7]
A TdT nincs jelen a magzati máj-HSC-kben, csökkentve a B-sejtek kapcsolati diverzitását a magzati fejlődés alatt.[8]
Funkció és szabályzás[szerkesztés]
A TdT a DNS 3’-végéhez való nukleotid-hozzáadást tartalmazza. A legtöbb DNS-polimerázzal ellentétben nem igényel templátot. Általános szubsztrátja 3’-többlet, de képes csonka vagy recesszált 3’-végekhez is nukleotidot adni. Továbbá ez az egyetlen polimeráz, mely képes 2–15 nt-os polimereket oldatban lévő szabad nukleotidokból előállítani in vivo.[9] In vitro ezen aktivitás képes általános DNS-polimer-képzésre meghatározott hossz nélkül.[10] Az in vivo létrejövő DNS-töredékek feltehetően a DNS-javításhoz vagy -rekombinációhoz kapcsolódó jelutakban fontosak.[9] Sok polimerázhoz hasonlóan a TdT-nek kétértékű kationos kofaktor kell,[11] azonban a TdT több iont (például Mg2+, Mn2+, Zn2+, Co2+) tud használni.[11] Enzimaktivitása az elérhető kationoktól és a hozzáadott nukleotidtól függ.[12]
A TdT-t elsősorban a primer limfoid szervek, például a csecsemőmirigy és a csontvelő expresszálják. Több út szabályozza például fehérje-fehérje kölcsönhatásokkal, mint a TdIF1-gyel, mely a DNS-kötő hely eltakarásával gátolja a TdT-t. A TdT-expresszió transzkripciós szinten is megtörténik, szabályzását szakaszspecifikus faktorok befolyásolják, ez fejlődésileg korlátozó módon történik.[3][13][14] Bár expressziója elsősorban a primer limfoid szövetekben történik, 2012-ben kimutatták, hogy az antigénstimuláció a TdT és más rekombinációhoz szükséges enzimek másodlagos termelését okozza a csecsemőmirigyen kívül a T-sejtekhez.[15] Az akut limfoblasztos leukémia jelentős TdT-túltermelést okoz.[12] E betegek sejtvonalai voltak a tiszta TdT egyik első forrása és a humán és marhaizoformák közti aktivitáskülönbségeket igazolták.[12]
Mechanizmus[szerkesztés]
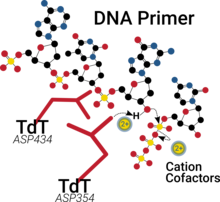
Sok polimerázhoz hasonlóan a TdT katalitikus helye 2 kétértékű kationnal rendelkezik a tenyérdoménben, segítve a nukleotidkötést, csökkentve a 3’-OH-csoport pKa-ját és könnyítve a difoszfát távozását.[16][17]
Izoformák[szerkesztés]
Számos izoformája ismert egérben, marhában és emberben. Egérben 2, emberben 3 variáns ismert.[18]
Az egérben lévő 2 izoformát hosszuknak megfelelően nevezték el: a TdTS 509, a TdTL 529 aminosavból áll. A különbségek a DNS- és nukleotidkötő részeken kívül vannak. Vitatott, hogy a 20 aminosavas különbség befolyásolja-e az aktivitást: egyesek szerint a TdTL exonukleáz, míg mások szerint a két izoforma in vitro hasonló aktivitással rendelkezik. Ezenkívül in vivo a TdTL modulálhatja a TdTS katalitikus aktivitását ismeretlen mechanizmus révén. Feltehetően ez segíti a TdT V(D)J-rekombinációs szerepét.[19]
A 3 humán TdT-izoforma a TdTL1, a TdTL2 és a TdTS. A TdTL1-et nagyrészt limfoid sejtek expresszálják, a TdTL2-t elsősorban normál kis limfociták. Mindkettő a sejtmagban lokalizálódik expressziókor,[20] és van 3’→5’-exonukleáz-aktivitásuk.[21] Ezzel szemben a TdTS nem rendelkezik exonukleázaktivitással és végzi a V(D)J-rekombinációhoz szükséges elongációt.[21] Mivel az egér-TdTL feltételezett exonukleázaktivitásához hasonló van a humán és marha-TdTL-ben, feltehetően a TdTS izoformákat ezek hasonlóan szabályozzák.[19] Ezenkívül feltehetően a TdTL1 érintett lehet a TdTL2- vagy a TdTS-szabályzásban is.
A V(D)J-rekombinációban[szerkesztés]
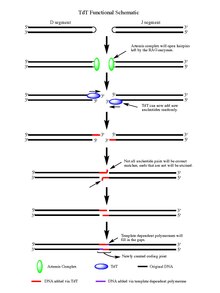
Az 1./2. RAG-enzimek működésekor a megbontott dsDNS hajtűszakaszokkal rendelkezik a DNS végén, melyek a bontáskor keletkeztek. A hajtűket az Artemisz-komplex nyitja, mely foszforilációkor endonukleázként működik, szabad 3’-OH-végeket biztosítva a TdT-nek a működéshez. Miután az Artemisz-komplex elvégezte feladatát és palindrom (P-) nukleotidokat adott a DNS-hajtűkhöz, a TdT végzi feladatát. Ez be tud jönni és N-nukleotidokat adni a létező P-nukleotidokhoz 5’–3’-irányban, melyben a polimerázok működése ismert. Átlagosan 2–5 véletlenszerű bázispár kerül az Artemisz-komplex működése után létrejövő 3’-végekhez. A hozzáadott bázisok száma elég a két új ssDNS-szakasz normál Watson–Crick-bázispárosodási mintáknak (A–T, C–G) megfelelő mikrohomológia-alapú elrendezéséhez a nem homológ végcsatlakoztatás során. A párosítatlan nukleotidokat egy exonukleáz, például az endonukleázaktivitás mellett exonukleázaktivitással rendelkező Artemisz-komplex eltávolítja, majd a templátdependens polimerázok kitölthetik a réseket, új kódoló kapcsolatot létesítve a ligáz révén a szakaszok összeillesztéséhez. Bár a TdT nem különbözteti meg a 4 bázispárt az N-nukleotidszakaszokhoz adáskor, a guanin–citozin bázispárok felé torzít.[3]
Templátdependens aktivitás[szerkesztés]

Templátdependensen a TdT a száltöréseken át nukleotidokat illeszthet be a kétszálú DNS-be in trans, szemben a legtöbb polimeráz in cis mechanizmusával. Ez optimálisan történik 1 bázispáros töréskor; nagyobb törés esetén kevésbé optimális. Ezt a TdT egy szakasza, a Loop1 könnyíti, mely szelektíven ellenőrzi a kétszálú DNS rövid töréseit. Továbbá e templátdependens aktivitás felfedezése erősebb mechanisztikus hipotézisekhez vezetett a V(D)J-rekombinációban az N-régiók bővülései hosszának eloszlása tekintetében.[22]

A DNS-polimeráz μ és λ hasonló in trans templátdependens szintetikus aktivitást mutatnak a későbbi dsDNS-től való függés nélkül.[23] Ezenkívül a Pol λ hasonló templátfüggetlen szintetikus aktivitást is mutatnak. A terminálistranszferáz-aktivitás mellett általánosabb templátdependens módon is működnek.[24] A TdT és a Pol μ hasonlóságai alapján közeli rokonok lehetnek.[22]
Használat[szerkesztés]
A TdT-t a molekuláris biológia használja. Használható a RACE-ben nukleotidok hozzáadására, melyek ezután templátként használhatók a későbbi PCR-ben. Használható radioizotópokkal jellt nukleotidok hozzáadására például a TUNEL-assayben (angolul: terminal deoxynucleotidyl transferase dUTP nick end labeling) az apoptózis kimutatására, melyet részben a töredezett DNS mutat. Használható immunfluoreszcencia-assayben akut limfoblasztos leukémia (ALL) diagnózisához.[25]
Az immun-isztokémia és az áramlás-citometria terén az anti-TdT használható az antigént tartalmazó éretlen T-, B-sejtek és vérképző őssejtek jelenlétének kimutatására, míg az érett limfoid sejtek mindig TdT-negatívak. Míg a TdT-pozitív sejtek kis mennyiségben megtalálhatók az egészséges nyirokcsomókban és mandulákban, az ALL rosszindulatú sejtjei is TdT-pozitívak, így az antitest használható a betegség diagnózisára és a gyermekkori kissejtes tumoroktól való megkülönböztetésre.[26]
A TdT-t 2018-tól használják oligonukleotidok de novo szintézisére: a TdT–dNTP analógok a primert egyszerre 1 nt-dal tudják bővíteni.[27] Tehát a TdT képes szintetikus DNS előállítására a primerszekvencia egyszerre egy betűvel való hosszabbításával.
Jegyzetek[szerkesztés]
- ↑ Isobe M, Huebner K, Erikson J, Peterson RC, Bollum FJ, Chang LM, Croce CM (1985. szeptember 1.). „Chromosome localization of the gene for human terminal deoxynucleotidyltransferase to region 10q23-q25”. Proceedings of the National Academy of Sciences of the United States of America 82 (17), 5836–5840. o. DOI:10.1073/pnas.82.17.5836. PMID 3862101.
- ↑ Yang-Feng TL, Landau NR, Baltimore D, Francke U (1986). „The terminal deoxynucleotidyltransferase gene is located on human chromosome 10 (10q23----q24) and on mouse chromosome 19”. Cytogenetics and Cell Genetics 43 (3–4), 121–126. o. DOI:10.1159/000132309. PMID 3467897.
- ↑ a b c d Motea EA, Berdis AJ (2010. május 1.). „Terminal deoxynucleotidyl transferase: the story of a misguided DNA polymerase”. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1804 (5), 1151–1166. o. DOI:10.1016/j.bbapap.2009.06.030. PMID 19596089.
- ↑ Haeryfar SM, Hickman HD, Irvine KR, Tscharke DC, Bennink JR, Yewdell JW (2008. július 1.). „Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies”. Journal of Immunology 181 (1), 649–659. o. DOI:10.4049/jimmunol.181.1.649. PMID 18566432.
- ↑ Bollum FJ (1960. augusztus 1.). „Calf thymus polymerase”. The Journal of Biological Chemistry 235 (8), 2399–2403. o. DOI:10.1016/S0021-9258(18)64634-4. PMID 13802334.
- ↑ Gouge J, Rosario S, Romain F, Poitevin F, Béguin P, Delarue M (2015. április 1.). „Structural basis for a novel mechanism of DNA bridging and alignment in eukaryotic DSB DNA repair”. The EMBO Journal 34 (8), 1126–42. o. DOI:10.15252/embj.201489643. PMID 25762590.
- ↑ Loc'h J, Delarue M (2018. december 1.). „Terminal deoxynucleotidyltransferase: the story of an untemplated DNA polymerase capable of DNA bridging and templated synthesis across strands”. Current Opinion in Structural Biology 53, 22–31. o. DOI:10.1016/j.sbi.2018.03.019. PMID 29656238.
- ↑ Hardy, Richard. Chapter 7: B Lymphocyte Development and Biology, Fundamental Immunology, 6th, Philadelphia: Lippincott Williams & Wilkins, 237–269. o. (2008). ISBN 978-0-7817-6519-0
- ↑ a b Ramadan K, Shevelev IV, Maga G, Hübscher U (2004. május 1.). „De novo DNA synthesis by human DNA polymerase lambda, DNA polymerase mu and terminal deoxyribonucleotidyl transferase”. Journal of Molecular Biology 339 (2), 395–404. o. DOI:10.1016/j.jmb.2004.03.056. PMID 15136041.
- ↑ Bollum FJ, Chang LM, Tsiapalis CM, Dorson JW. 8. Nucleotide polymerizing enzymes from calf thymus gland, Nucleotide polymerizing enzymes from calf thymus gland, Methods in Enzymology, 70–81. o.. DOI: 10.1016/0076-6879(74)29010-4 (1974). ISBN 9780121818920
- ↑ a b Chang LM, Bollum FJ (1970. április 1.). „Deoxynucleotide-polymerizing enzymes of calf thymus gland”. Proceedings of the National Academy of Sciences of the United States of America 65 (4), 1041–1048. o. DOI:10.1073/pnas.65.4.1041. PMID 4985880.
- ↑ a b c Deibel MR, Coleman MS (1980. május 1.). „Biochemical properties of purified human terminal deoxynucleotidyltransferase”. The Journal of Biological Chemistry 255 (9), 4206–4212. o. DOI:10.1016/S0021-9258(19)85653-3. PMID 7372675.
- ↑ Cherrier M, D'Andon MF, Rougeon F, Doyen N (2008. február 1.). „Identification of a new cis-regulatory element of the terminal deoxynucleotidyl transferase gene in the 5' region of the murine locus”. Molecular Immunology 45 (4), 1009–1017. o. DOI:10.1016/j.molimm.2007.07.027. PMID 17854898.
- ↑ Kubota T, Maezawa S, Koiwai K, Hayano T, Koiwai O (2007. augusztus 1.). „Identification of functional domains in TdIF1 and its inhibitory mechanism for TdT activity”. Genes to Cells 12 (8), 941–959. o. DOI:10.1111/j.1365-2443.2007.01105.x. PMID 17663723.
- ↑ Zhang Y, Shi M, Wen Q, Luo W, Yang Z, Zhou M, Ma L (2012. január 1.). „Antigenic stimulation induces recombination activating gene 1 and terminal deoxynucleotidyl transferase expression in a murine T-cell hybridoma”. Cellular Immunology 274 (1–2), 19–25. o. DOI:10.1016/j.cellimm.2012.02.008. PMID 22464913.
- ↑ Vashishtha AK, Wang J, Konigsberg WH (2016. szeptember 1.). „Different Divalent Cations Alter the Kinetics and Fidelity of DNA Polymerases”. The Journal of Biological Chemistry 291 (40), 20869–20875. o. DOI:10.1074/jbc.R116.742494. PMID 27462081.
- ↑ Delarue M, Boulé JB, Lescar J, Expert-Bezançon N, Jourdan N, Sukumar N, Rougeon F, Papanicolaou C (2002. február 1.). „Crystal structures of a template-independent DNA polymerase: murine terminal deoxynucleotidyltransferase”. The EMBO Journal 21 (3), 427–439. o. DOI:10.1093/emboj/21.3.427. PMID 11823435.
- ↑ Steenberg ML, Lokhandwala MF, Jandhyala BS (1988). „Abnormalities in the sodium transport as the causative factor for enhanced norepinephrine overflow in the spontaneously hypertensive rat”. Clinical & Experimental Hypertension, Part A 10 (5), 833–841. o. DOI:10.1080/07300077.1988.11878788. PMID 2846215.
- ↑ a b Schmoldt A, Benthe HF, Haberland G (1975. szeptember 1.). „Digitoxin metabolism by rat liver microsomes”. Biochemical Pharmacology 24 (17), 1639–41. o. DOI:10.1016/0006-2952(75)90094-5. PMID 10.
- ↑ Thai TH, Kearney JF (2004. szeptember 1.). „Distinct and opposite activities of human terminal deoxynucleotidyltransferase splice variants”. Journal of Immunology 173 (6), 4009–4019. o. DOI:10.4049/jimmunol.173.6.4009. PMID 15356150.
- ↑ a b Thai TH, Kearney JF. Isoforms of Terminal Deoxynucleotidyltransferase: Developmental Aspects and Function, Advances in Immunology, 113–136. o.. DOI: 10.1016/S0065-2776(04)86003-6 (2005). ISBN 9780120044863
- ↑ a b Bland RD, Clarke TL, Harden LB (1976. február 1.). „Rapid infusion of sodium bicarbonate and albumin into high-risk premature infants soon after birth: a controlled, prospective trial”. American Journal of Obstetrics and Gynecology 124 (3), 263–267. o. DOI:10.1016/0002-9378(76)90154-x. PMID 2013.
- ↑ Martin MJ, Blanco L (2014. július 1.). „Decision-making during NHEJ: a network of interactions in human Polμ implicated in substrate recognition and end-bridging”. Nucleic Acids Research 42 (12), 7923–7934. o. DOI:10.1093/nar/gku475. PMID 24878922.
- ↑ Maga G, Ramadan K, Locatelli GA, Shevelev I, Spadari S, Hübscher U (2005. január 1.). „DNA elongation by the human DNA polymerase lambda polymerase and terminal transferase activities are differentially coordinated by proliferating cell nuclear antigen and replication protein A”. The Journal of Biological Chemistry 280 (3), 1971–1981. o. DOI:10.1074/jbc.M411650200. PMID 15537631.
- ↑ Faber J, Kantarjian H, Roberts MW, Keating M, Freireich E, Albitar M (2000. január 1.). „Terminal deoxynucleotidyl transferase-negative acute lymphoblastic leukemia”. Archives of Pathology & Laboratory Medicine 124 (1), 92–97. o. DOI:10.5858/2000-124-0092-TDTNAL. PMID 10629138.
- ↑ Leong, Anthony S-Y. Manual of Diagnostic Cytology, 2nd, Greenwich Medical Media, Ltd., 413–414. o. (2003). ISBN 1-84110-100-1
- ↑ Palluk S, Arlow DH, de Rond T, Barthel S, Kang JS, Bector R, Baghdassarian HM, Truong AN, Kim PW, Singh AK, Hillson NJ, Keasling JD (2018. augusztus 1.). „De novo DNA synthesis using polymerase-nucleotide conjugates”. Nature Biotechnology 36 (7), 645–650. o. DOI:10.1038/nbt.4173. PMID 29912208.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Terminal deoxynucleotidyl transferase című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
- O'Malley DP, Orazi A (2006. augusztus 1.). „Terminal deoxynucleotidyl transferase-positive cells in spleen, appendix and branchial cleft cysts in pediatric patients”. Haematologica 91 (8), 1139–1140. o. PMID 16885057.
- Yamashita N, Shimazaki N, Ibe S, Kaneko R, Tanabe A, Toyomoto T, Fujita K, Hasegawa T, Toji S, Tamai K, Yamamoto H, Koiwai O (2001. július 1.). „Terminal deoxynucleotidyltransferase directly interacts with a novel nuclear protein that is homologous to p65”. Genes to Cells 6 (7), 641–52. o. DOI:10.1046/j.1365-2443.2001.00449.x. PMID 11473582.
- Chang LM, Bollum FJ (1986). „Molecular biology of terminal transferase”. CRC Critical Reviews in Biochemistry 21 (1), 27–52. o. DOI:10.3109/10409238609113608. PMID 3524991.
- Maezawa S, Hayano T, Koiwai K, Fukushima R, Kouda K, Kubota T, Koiwai O (2008. május 1.). „Bood POZ containing gene type 2 is a human counterpart of yeast Btb3p and promotes the degradation of terminal deoxynucleotidyltransferase”. Genes to Cells 13 (5), 439–57. o. DOI:10.1111/j.1365-2443.2008.01179.x. PMID 18429817.
- Taplin ME, Frantz ME, Canning C, Ritz J, Blumberg RS, Balk SP (1996. március 1.). „Evidence against T-cell development in the adult human intestinal mucosa based upon lack of terminal deoxynucleotidyltransferase expression”. Immunology 87 (3), 402–7. o. DOI:10.1046/j.1365-2567.1996.496571.x. PMID 8778025.
- Grupe A, Li Y, Rowland C, Nowotny P, Hinrichs AL, Smemo S, Kauwe JS, Maxwell TJ, Cherny S, Doil L, Tacey K, van Luchene R, Myers A, Wavrant-De Vrièze F, Kaleem M, Hollingworth P, Jehu L, Foy C, Archer N, Hamilton G, Holmans P, Morris CM, Catanese J, Sninsky J, White TJ, Powell J, Hardy J, O'Donovan M, Lovestone S, Jones L, Morris JC, Thal L, Owen M, Williams J, Goate A (2006. január 1.). „A scan of chromosome 10 identifies a novel locus showing strong association with late-onset Alzheimer disease”. American Journal of Human Genetics 78 (1), 78–88. o. DOI:10.1086/498851. PMID 16385451.
- Dworzak MN, Fritsch G, Fröschl G, Printz D, Gadner H (1998. november 1.). „Four-color flow cytometric investigation of terminal deoxynucleotidyl transferase-positive lymphoid precursors in pediatric bone marrow: CD79a expression precedes CD19 in early B-cell ontogeny”. Blood 92 (9), 3203–3209. o. DOI:10.1182/blood.V92.9.3203. PMID 9787156.
- Fujita K, Shimazaki N, Ohta Y, Kubota T, Ibe S, Toji S, Tamai K, Fujisaki S, Hayano T, Koiwai O (2003. június 1.). „Terminal deoxynucleotidyltransferase forms a ternary complex with a novel chromatin remodeling protein with 82 kDa and core histone”. Genes to Cells 8 (6), 559–71. o. DOI:10.1046/j.1365-2443.2003.00656.x. PMID 12786946.
- Kubota T, Maezawa S, Koiwai K, Hayano T, Koiwai O (2007. augusztus 1.). „Identification of functional domains in TdIF1 and its inhibitory mechanism for TdT activity”. Genes to Cells 12 (8), 941–59. o. DOI:10.1111/j.1365-2443.2007.01105.x. PMID 17663723.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (1997. október 1.). „Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library”. Gene 200 (1–2), 149–156. o. DOI:10.1016/S0378-1119(97)00411-3. PMID 9373149.
- Bridges SL (1998. augusztus 1.). „Frequent N addition and clonal relatedness among immunoglobulin lambda light chains expressed in rheumatoid arthritis synovia and PBL, and the influence of V lambda gene segment utilization on CDR3 length”. Molecular Medicine 4 (8), 525–553. o. DOI:10.1007/BF03401757. PMID 9742508.
- Liu L, McGavran L, Lovell MA, Wei Q, Jamieson BA, Williams SA, Dirks NN, Danielson MS, Dubie LM, Liang X (2004. június 1.). „Nonpositive terminal deoxynucleotidyl transferase in pediatric precursor B-lymphoblastic leukemia”. American Journal of Clinical Pathology 121 (6), 810–815. o. DOI:10.1309/QD18-PPV1-NH3T-EUTF. PMID 15198352.
- Yang B, Gathy KN, Coleman MS (1994. április 1.). „Mutational analysis of residues in the nucleotide binding domain of human terminal deoxynucleotidyl transferase”. The Journal of Biological Chemistry 269 (16), 11859–11868. o. DOI:10.1016/S0021-9258(17)32652-2. PMID 8163485.
- Thai TH, Kearney JF (2004. szeptember 1.). „Distinct and opposite activities of human terminal deoxynucleotidyltransferase splice variants”. Journal of Immunology 173 (6), 4009–4019. o. DOI:10.4049/jimmunol.173.6.4009. PMID 15356150.
- Shimazaki N, Fujita K, Koiwai O (2002. március 1.). „[Expression and function of terminal deoxynucleotidyl-transferase and discovery of novel DNA polymerase mu]”. Seikagaku. The Journal of Japanese Biochemical Society 74 (3), 227–232. o. PMID 11974916.
- Mahajan KN, Mitchell BS (2003. szeptember 1.). „Role of human Pso4 in mammalian DNA repair and association with terminal deoxynucleotidyl transferase”. Proceedings of the National Academy of Sciences of the United States of America 100 (19), 10746–10751. o. DOI:10.1073/pnas.1631060100. PMID 12960389.
- Mahajan KN, Gangi-Peterson L, Sorscher DH, Wang J, Gathy KN, Mahajan NP, Reeves WH, Mitchell BS (1999. november 1.). „Association of terminal deoxynucleotidyl transferase with Ku”. Proceedings of the National Academy of Sciences of the United States of America 96 (24), 13926–13931. o. DOI:10.1073/pnas.96.24.13926. PMID 10570175.
- Ibe S, Fujita K, Toyomoto T, Shimazaki N, Kaneko R, Tanabe A, Takebe I, Kuroda S, Kobayashi T, Toji S, Tamai K, Yamamoto H, Koiwai O (2001. szeptember 1.). „Terminal deoxynucleotidyltransferase is negatively regulated by direct interaction with proliferating cell nuclear antigen”. Genes to Cells 6 (9), 815–824. o. DOI:10.1046/j.1365-2443.2001.00460.x. PMID 11554927.
- Terminal+Deoxyribonucleotidyltransferase a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |
