DNS-polimeráz

A DNS-polimerázok (EC 2.7.7.7) a nukleozid-trifoszfátokból, a DNS prekurzoraiból történő dezoxiribonukleinsav-szintézist katalizáló enzimcsalád. Ezek az enzimek fontosak a DNS-replikációhoz, és általában csoportban működnek, hogy két azonos DNS-duplexet hozzon létre egy eredeti DNS-duplexből. E folyamat során a DNS-polimeráz „elolvassa” a meglévő DNS-szálakat, hogy a meglévőkkel egyező új szálakat hozzon létre.[1][2][3][4][5][6] Ezek az enzimek a
- dezoxiribonukleozid-trifoszfát + n lánchosszú DNS → pirofoszfát + n+1 lánchosszú DNS
kémiai reakciót katalizálják. A DNS-polimerázok a DNS-szál 3’-végéhez adják egyesével a nukleotidokat. Minden alkalommal, mikor egy sejt osztódik, DNS-polimerázra van szükség a sejt DNS-ének megkettőzéséhez, hogy az eredeti DNS másolata átöröklődjék mindkét leánysejthez. Így öröklődik a genetikai információ generációról generációra.
A replikáció előtt a helikáz kilazítja a DNS-t szorosan kapcsolt alakjából a nukleobázisok közti hidrogénkötések felszakításával. Ez a kettős szálú DNS-t két DNS-szállá nyitja fel, amik így a fenti reakcióban templátként felhasználhatókká válnak.
Története[szerkesztés]
1956-ban Arthur Kornberg és munkatársai felfedezték az Escherichia coliban a DNS-polimeráz I-et (Pol I). A DNS-replikációs folyamatot úgy írták le, ahol a DNS-polimeráz egy DNS-templátszál bázisszekvenciáját másolja le. Kornbergnek 1959-ben odaítélték az orvostudományi Nobel-díjat ezért a munkáért.[7] A DNS-polimeráz II-t Thomas Kornberg (Arthur Kornberg fia) és Malcolm E. Gefter fedezték fel 1970-ben a Pol I E. coli DNS-replikációs szerepében játszott szerepének kutatása közben.[8] 3 további DNS-polimerázt találtak az E. coliban: az 1970-es években felfedezett DNS-polimeráz III-at, a DNS-polimeráz IV-et és az 1999-ben felfedezett DNS-polimeráz V-öt.[9]
Funkció[szerkesztés]
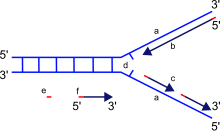

A DNS-polimeráz fő funkciója, hogy DNS-t hozzon létre annak alkotóelemeiből, a dezoxiribonukleotidokból. Ezzel szemben az RNS-polimerázok az RNS-t RNS-ből vagy DNS-ből származó ribonukleotidokból szintetizálják. A DNS-másolatok a nukleotidok az eredeti DNS-molekula szálain lévő bázisokhoz való párosításával jönnek létre. Ez a párosítás mindig azonos kombinációkkal jön létre: a citozin a guaninnal, a timin az adeninnel párosítható, két elkülönülő párt alkotva.
Új DNS szintézise közben a DNS-polimeráz csak az új szál 3’ végéhez adhat szabad nukleotidokat, ennek következménye az új szálnak az 5’-vég felől a 3’-vég felé történő elongációja.
Fontos megjegyezni, hogy az újonnan létrejövő szál iránya ellentétes azon iránnyal, amerre a DNS-polimeráz megy a meglévő szálon. Mivel a DNS-polimeráznak szabad 3’-OH-csoportra van szüksége a szintézis elindításához, csak egy irányba tud szintetizálni a meglévő nukleotidlánc 3’-végének meghosszabbításával. Ezért a DNS-polimeráz a meglévő szálon a 3’ vég felől az 5’ vég felé halad, és a leányszál az 5’ vég felől a 3’ vég felé jön létre. Ez a különbség teszi lehetővé, hogy a létrejövő kétszálú DNS két egymással ellentétes irányú szálból álljon.
A DNS-polimeráz működése nem teljesen tökéletes: az enzim mintegy egymilliárd másolt bázispáronként egyszer hibázik. Néhány DNS-polimeráz képes az újonnan létrehozott DNS hibáit kijavítani. Hibás bázispár észlelésekor a DNS-polimeráz egy bázispárral visszamegy. Az enzim 3’–5’ exonukleázaktivitása lehetővé teszi a bázis eltávolítását a hibás bázispárból. Ezután a polimeráz újra elhelyezheti a helyes bázist, és a replikáció folytatódhat tovább. Ez megőrzi a leánysejteknek továbbadandó eredeti DNS-szál integritását.
A hitelesség nagyon fontos a DNS-replikációban. A DNS-bázispárok hibái nem megfelelően működő fehérjékhez vagy rákhoz vezethetnek. Számos DNS-polimeráz tartalmaz exonukleázdomént, ami a bázispárok hibáinak észlelésében és a hibás nukleotid eltávolításában játszik szerepet, hogy az kicserélődjön a helyesre.[10] A Watson–Crick-bázispárt jellemző alakzat és a kölcsönhatások járulnak hozzá elsősorban az észleléshez vagy a hibához. A hidrogénkötések a bázispárok kialakulásában és kölcsönhatásában fontos szerepet játszanak. A nem megfelelő bázis esetén megszűnő kölcsönhatás eltolja a templát kötésének egyensúlyát a polimerázról az exonukleázdoménre, továbbá egy nem megfelelő nukleotid beépítése a DNS-polimerizációban késést okoz. Ez a késés időt ad a DNS-nek, hogy a polimerázról az exonukleázra váltson. A különböző hibák különböző konformációs változások és kölcsönhatásvesztés okai. Egy purin:pirimidin hiba esetén a pirimidin eltolódik a nagy, a purin a kis nyílás felé. A DNS-polimeráz kötőhelyének alakjából eredően a sztérikus hatások a purin és a kis nyílásban lévő származékok közt alakulnak ki, és fontos van der Waals- és elektrosztatikus kölcsönhatások vesznek el a pirimidin által.[11] A pirimidin:pirimidin és a purin:purin hibák kevésbé észlelhető változásokat eredményeznek, mert a bázisok a nagy nyílás felé tolódnak el, és kevesebb sztérikus gát tapasztalható. De míg a különböző hibák különböző sztérikus tulajdonságokat eredményeznek, a DNS-polimeráz képes egységesen észlelni és megkülönböztetni őket, és fenntartani a DNS-replikáció hitelességét.[12] A DNS-polimerizáció fontos számos mutagenezis-folyamathoz, és gyakran használják a biotechnológiában.
Szerkezet[szerkesztés]
Az ismert DNS-polimerázok szerkezete nem túl változatos, vagyis a katalitikus alegységek fajonként nagyon kevéssé térnek el, függetlenül a doménszerkezettől. A megőrzött struktúrák általában a sejt fontos, megváltoztathatatlan funkcióit jelzik, karbantartásuk evolúciós előnyöket jelent. A középső domén funkciója a foszforilcsoportok transzferének katalízise a foszforiltranszfer-reakcióban. A DNS a középső doménhez kapcsolódik, mikor az enzim aktív. E reakcióról úgy gondolják, hogy egy két fémionos mechanizmus katalizálja. Az egyik szélső domén a nukleozid-trifoszfátokat a templát nukleobázisához kapcsolja, a másik a DNS elhelyezkedésében, áthelyezésében és működésében játszhat szerepet.[13]
Működés[szerkesztés]
A DNS-polimeráz gyors katalízisét a működése okozza. A processzivitás a polimerszubsztrátú enzimek egyik jellemzője. A DNS-polimeráz esetén a processzivitás foka a templáthoz való kötődéskor hozzáadott nukleotidok átlagos számára utal. Az átlagos DNS-polimeráznak egy másodperc kell megtalálni és kötődni a primer-templát kapcsolathoz. Amint kapcsolódott, egy nem processzív DNS-polimeráz másodpercenként egy nukleotidot ad hozzá.[14]:207–208 A processzív DNS-polimerázok viszont másodpercenként több nukleotidot adnak hozzá, jelentősen megnövelve a DNS-szintézis sebességét. A processzivitás foka a DNS-szintézis rátájával arányos. A DNS-szintézis rátáját élő sejtben először egy T4 fág DNS-elongációs rátájaként határozták meg a fággal fertőzött E. coliban. 37 °C-on az exponenciális DNS-mennyiségnövekedés ideje alatt a ráta 749 nukleotid volt másodpercenként.[15]
A DNS-polimeráz DNS-templáton való mozgásra való képessége lehetővé teszi a megnövekedett processzivitást. Jelentős processzivitásnövekedés van a replikációs villánál. Ezt a növekedést a DNS-polimeráz fehérjékkel való asszociációja segíti elő. Az asszociátumok többfehérjés, gyűrű alakú alegységek. Az ATP hidrolízisét felhasználva a csúszó asszociátumot betöltő fehérjék megnyitják az asszociátumok gyűrűs szerkezetét, ami lehetővé teszi a DNS-szálhoz való kötődést és a tőle való eloldást. Az asszociátummal való fehérje-fehérje kölcsönhatás megakadályozza a DNS-polimeráz diffúzióját a DNS-templáttól, így biztosítva, hogy az enzim egyazon primer-templát kapcsolathoz kötődik, és folytatja a replikációt.[14]:207–208 A DNS-polimeráz konformációt vált, megnövelve az asszociátumhoz való affinitást, mikor vele van asszociálva, és csökkentve az affinitást, mikor egy DNS-szakasz replikációjával kész, hogy az asszociátumtól eloldja.
Szekvenciahomológia alapján a DNS-polimerázokat hét különböző családba osztják: A, B, C, D, X, Y és RT.
Néhány vírus különleges DNS-polimerázokat is kódol, mint amilyen a Hepatitis B vírus DNS-polimeráz. Ezek szelektíven replikálhatják a vírus-DNS-t különböző mechanizmusok által. A retrovírusok a reverz transzkriptázzal, egy RNS-dependens DNS-polimerázzal sokszorozzák DNS-üket, ami azt jelenti, hogy a DNS-t RNS-templátból polimerizálják.
| Család[16] | DNS-polimeráz-típusok | Taxonok | Példák | Jellemzők |
|---|---|---|---|---|
| A | replikatív és javító polimerázok | eukarióta és prokarióta | T7 DNS-polimeráz, Pol I, Pol γ, θ és ν | két exonukleázdomén (3’-5’ és 5’-3’) |
| B | replikatív és javító polimerázok | eukarióta és prokarióta | Pol II, Pol B, Pol ζ, Pol α, δ és ε | 3’-5’ exonukleáz (javító funkció); a virálisak fehérjeprimert használnak |
| C | replikatív polimerázok | prokarióta | Pol III | 3’-5’ exonukleáz (javító funkció) |
| D | replikatív polimerázok | Euryarchaeota | PolD (DP1/DP2 heterodimer)[17] | Nincs kézszerű képlet; RNS-polimeráz-szerű; 3’-5’-exonukleáz (javító funkció) |
| X | replikatív és javító polimerázok | eukarióta | Pol β, Pol σ, Pol λ, Pol μ és terminális dezoxinukleotidil-transzferáz | opcionális templát; 5’-foszfatáz (csak a Pol β esetén); gyenge kézszerű képlet |
| Y | replikatív és javító polimerázok | eukarióta és prokarióta | Pol ι, Pol κ, Pol η,[18] Pol IV és Pol V | transzléziós szintézis[19] |
| RT | replikatív és javító polimerázok | vírusok, retrovírusok és eukarióták | telomeráz, Hepatitis B-vírus | RNS-dependens |
Prokarióta polimerázok[szerkesztés]
A prokarióta polimerázoknak két fajtájuk van: a magpolimeráz és a holoenzim. A magpolimeráz a DNS-t a templátból szintetizálja, de nem képes egyedül vagy pontosan elindítani a szintézist. A holoenzim pontosan képes elindítani a szintézist.
Pol I[szerkesztés]
Az A családba tartozó polimerázok közé tartozik a DNS-polimeráz I (Pol I) enzim, amit a polA gén kódol, és gyakori a prokarióták közt. Ez a javító polimeráz a báziskivágásos javításban vesz részt, mind 3’–5’, mind 5’–3’ exonukleáz-aktivitással, és a szálszintézis során keletkező Okazaki-fragmentumok feldolgozásával.[20] A Pol I a leggyakoribb polimeráz, az E. coliban a polimerázaktivitás több mint 95%-át adja, mégis ismertek Pol I nélküli sejtek, tehát feltételezhető, hogy a Pol I funkcióit pótolhatja a másik négy polimeráz. A Pol I 15-20 nukleotidot ad a primerhez másodpercenként, ami alacsony processzivitást jelent. Viszont a Pol I a nukleotidokat az RNS primer:templát kapcsolathoz adja, aminek a neve replikációs origó. Körülbelül 400 bázispárral az origó alatt létrejön a Pol III holoenzim, és nagy sebességgel folytatja a replikációt.[21]
A Taq polimeráz ennek a családnak egy hőálló tagja, ami nem képes hibajavításra.[22]
Pol II[szerkesztés]
A DNS-polimeráz II a B családba tartozó polimeráz, amit a polB gén kódol. A Pol II 3’-5’-exonukleáz-aktivitással rendelkezik, a DNS-javításban, a replikáció újraindításában játszik szerepet a sérülések elkerülésére. Jelenléte a sejtben megnőhet sejtenként 30-50 másolatról 200-300-ra SOS-indukció esetén. A Pol II feltételezések szerint a Pol III helyettesítője, mert holoenzim-fehérjékre képes hatni, és magas a processzivitása. A Pol II fő szerepe feltehetően a polimerázaktivitás replikációs villa felé történő irányítása és a megakadt Pol III nem megfelelő terminális párosításainak átlépésének segítése.[23]
A Pfu DNS-polimeráz e család egy hőálló tagja, ami a Pyrococcus furiosus archeában található meg.[24] A részletes osztályozás az archeákban található B családot B1-re, B2-re és B3-ra osztja, ahol a B2 pszeudoenzimek csoportja. A Pfu a B3 család tagja. Az archeákban található további PolB-k a „kaszpozonok” (Cas1-dependens transzpozonok) részei.[25] Néhány vírus és mitokondriális plazmid szintén polB-t hordoz.[26]
Pol III[szerkesztés]
A DNS-polimeráz III holoenzim a DNS-replikációban résztvevő elsődleges enzim az E. coliban, és a polimerázok C családjába tartozik. Három részből áll: a Pol III-magból, a béta-DNS-kapocs-processzivitási faktorból és a kapocskomplexből. A mag három alegységből áll: az α-alegység a polimerázaktivitási központ, az ɛ-alegység az exonukleolitikus ellenőrző, a θ-alegység az ɛ stabilizátora. Magonként egy béta-kapocs-processzivitási faktor a duplikátumokban is megtalálható, hogy a DNS-t körülvevő kapcsot hozzon létre, ami lehetővé teszi a magas processzivitást.[27] A harmadik rész egy hét alegységes (τ2γδδ′χψ) komplex.
A régi könyvekben lévő „harsonamodell” a mmagenzim replikációs villánként két (szálanként egy) megfelelőjével rendelkező elongációs komplexet ír le,[23] De az egymolekula-tanulmányok tanúsága szerint a magenzimnek átlagosan három sztöchiometriai megfelelője van minden replikációs villánál mind a Pol III-nél, mind annak B. subtilis-megfelelőjénél, a PolC-nél.[28] A sejten belüli fluoreszcenciamikroszkópia alapján a vezetőszál-szintézis nem teljesen folytonos, és a Pol III* (azaz az α, ε, τ, δ és χ holoenzim-alegységek a β2 kapocsegység nélkül) gyakran válnak külön az aktív replikációs villáktól.[29] E tanulmányokban a replikációsvilla-megfordulási arány mintegy 10 s volt a Pol III*-nál, 47 s a β2 kapocsnál, illetve mintegy 15 perc a DnaB helikáznál. Eszerint a DnaB helikáz a replikációs villákhoz asszociált marad, és a holoenzim nukleációs pontjaként szolgál. In vitro egymolekula-tanulmányok szerint a Pol III* többlet esetén gyakran vált replikációs villát, de stabil asszociátumot képez a replikációs villákkal, ha kevés van belőle.[29] Egy másik egymolekulás tanulmány szerint a DnaB helikáz aktivitása és a szálelongáció sztochasztikusan is végbemehet.[29]
Pol IV[szerkesztés]
Az E. coliban a DNS-polimeráz IV (Pol IV) egy hibákra képes DNS-polimeráz, ami a nem célzott mutagenezisben vesz részt.[30] A Pol IV a polimerázok Y családjába tartozik, és a dinB gén kódolja, amit a replikációs villánál megakadt polimerázok okozta SOS-indukció kapcsol be. A SOS-indukció alatt a Pol IV-termelés tízszeresére növekszik, és az egyik funkciója ezalatt a Pol III holoenzimmel való interferencia. Ez ellenőrzőpontot hoz létre, leállítja a replikációt, és lehetővé teszi a DNS sérüléseinek a megfelelő módon történő kijavítását.[31] A Pol IV másik funkciója a transzléziós szintézis végrehajtása a replikációs villánál, mint például hogy N2-dezoxiguanin adduktumokon gyorsabban halad át, mint a nem sérült DNS-en. A dinB gént nem tartalmazó sejtekben nagyobb valószínűséggel fordul elő mutagén anyagok miatt mutagenezis.[32]
Pol V[szerkesztés]
A DNS-polimeráz V (Pol V) egy, az Y családba tartozó DNS-polimeráz, ami a SOS-válaszban és a transzléziós szintézisben vesz részt.[33] A Pol V umuDC gének általi transzkripciója erősen szabályozott: csak akkor termel Pol V-öt, ha sérült DNS van a sejtben, ami SOS-választ hoz létre. A leállt polimerázok miatt a RecA az ssDNS-hez kötődik, ezért a LexA fehérje lebomlik. A LexA elveszti az umuDC operon transzkripciójának elfojtását. Ugyanez a RecA–ssDNS nukleoprotein az UmuD fehérjét poszttranszlacionálisan UmuD’ fehérjévé alakítja. Az UmuD és az UmuD’ heterodimert alkotnak, ami aktiválja az umuC polimerázkatalizátort a sérült DNS-en.[34] A leállt replikációs villák esetén az E. coliban végbemenő Pol III–Pol IV-polimerázváltásokra „futószalagmodellt” feltételeznek, ahol a β-kapocshoz mindkét polimeráz egyidejűleg kötődik.[35] Azonban még nem mutatták ki egynél több TLS-polimeráz egymás utáni működését egy lézió áthidalására. Ezenkívül a Pol IV mind az inzertációt, mind a bővítést magas hatékonysággal tudja katalizálni, míg a Pol V-t a legfőbb SOS TLS-polimeráznak gondolják. Egy példa erre a szálon belüli guanin–timin keresztkötés, ahol a két polimeráz mutációs jeleiben lévő különbsége alapján megmutatták, hogy a Pol IV és a Pol V verseng a szálon belüli keresztkötésének TLS-éért.[35]
D család[szerkesztés]

1998-ban felfedezték a DNS-polimerázok D családját a Pyrococcus furiosusban és a Methanococcus jannaschiiban.[37] A PolD komplex egy kétláncos heterodimer, amiket a DP1 (kis hibajavító szerkezet) és a DP2 (nagy katalitikus mag) kódol. A többi DNS-polimerázzal ellentétben a DP2 katalitikus mag szerkezete és mechanizmusa hasonlít a több alegységből álló RNS-polimerázokéhoz. A DP1-DP2 határfelület hasonlít az eukarióta B osztályú polimeráz cinktartalmú egységére és annak a kis alegységére.[17] Egy Mre11-szerű exonukleáz, a DP1[38] valószínűleg a DNS-polimeráz α és ε 2-es alegységének a prekurzora, ami lehetővé tesz az eukariótákban meg nem lévő hibajavító képességeket.[25] Az N-terminális HSH domén szerkezete hasonlít az AAA-fehérjékre, legfőképp a Pol III δ-alegységére és az RuvB-re.[39] A DP2-ben II. osztályú KH domén van.[17] A Pyrococcus abyssi polD-je jobban ellenáll a hőre, és pontosabb a Taq polimeráznál, de nincs még kereskedelmi forgalomban.[40] Feltételezések szerint a D családbeli DNS-polimerázok voltak az elsők, amik az élőlényekben kifejlődtek, és hogy az utolsó közös ős (LUCA) replikatív polimeráza a D családba tartozott.[41]
Eukarióta DNS-polimerázok[szerkesztés]
β-, λ-, σ-, μ- (béta, lambda, szigma, mű) és TdT-polimerázok[szerkesztés]
Az X-családba tartozó polimerázok közé tartozik az ismert eukarióta polimeráz, a Pol β (béta), akárcsak a többi eukarióta polimeráz, mint a Pol σ (szigma), Pol λ (lambda), Pol μ (mű) és a terminális dezoxinukleotidil-transzferáz (TdT). A polimerázok X-családja általában gerincesekben található meg, de némely tagja növényekben és gombákban is megtalálható. E polimerázok erősen megőrzött régiókkal rendelkeznek, amikben két hélix-hajtű-hélix elrendeződés van, amik fontosak a DNS–DNS-polimeráz-kölcsönhatásokban. Egy ilyen a DNS-sel annak 3’-vége felé reagáló 8 kDa-os doménben található, és egy ilyen található a primerrel kölcsönható doménben is. A POLB gén kódolta Pol β szükséges a báziskivágó javításhoz, ami az alkilezett vagy oxidált bázisok, valamint a bázismentes területek javításához szükséges DNS-javítási mód. A rendre a POLL és a POLM által kódolt Pol λ és a Pol μ a nem homológ végcsatlakoztatásban játszanak szerepet, ami a DNS kettős szálának rendre a hidrogén-peroxid és az ionizáló sugárzás miatti szakadásait javítja ki. A TdT csak a limfoid szövetben fejeződik ki, és „n-nukleotidokat” ad a kettős szál V(D)J rekombináció során keletkezett szakadásaihoz, hogy az immunológiai diverzitást elősegítse.[42]
α-, δ- és ε- (alfa, delta és epszilon) polimerázok[szerkesztés]
A Pol α, Pol δ és a Pol ε a B-család tagjai, és a fő polimerázok, melyek a magi DNS-replikációban részt vesznek. A Pol α-komplex (Pol α-DNS-primáz-komplex) négy alegységből áll: a katalitikus POLA1 alegységből, a szabályozó POLA2-ből, a PRIM1-ből és a PRIM2-ből, amik rendre a kis és a nagy primáz-alegységek. Amint a primáz elkészítette az RNS-primert, a Pol α elkezdi a replikációt a primer kb. 20 nukleotiddal való elongációjával.[43] Magas processzivitása miatt a Pol δ átveszi a szálszintézist a Pol α-tól.[14]:218–219 A Pol δ-t a katalitikus alegységet létrehozó POLD1 gén és a többi, a PCNA-val, egy, a Pol δ processzivitását lehetővé tevő DNS-kapoccsal kölcsönható alegységet kódoló POLD2, POLD3 és POLD4 kódolják.[44] A Pol ε-t a POLE1, POLE2 és POLE3 gének kódolják. A Pol ε funkciója feltehetően a vezető szál meghosszabbítása a replikáció közben,[45][46] míg a Pol δ a másik szálat replikálja, viszont újabb kutatások szerint a Pol δ szerepet játszhat a DNS vezető szálának replikációjában is.[47] A Pol ε C-terminális „polimeráz” régiója, noha a polimerázaktivitáshoz nem szükséges,[48] feltételezések szerint a sejt életben maradásához igen. A C-terminális régió feltételezések szerint az anafázisba lépés előtt ellenőrzőpontot hoz létre, biztosítja a holoenzim stabilitását, és a replikáció elindításához fehérjéket ad a holoenzimhez.[49] A Pol ε-nak nagyobb „tenyér” doménje van, ami a PCNA-tól függetlenül biztosítja a magas processzivitást.[48]
A hibajavításért felelős DEDD exonukleáz-család inaktív a Pol α-ban.[25] A Pol ε egyedi jellemzője, hogy két cinktartalmú ujjdoménje és egy másik B családbeli polimeráz inaktív változata van benne jelen C-terminálisan. A cinktartalmú ujj jelenléte az eukarióták eredetének meghatározásában játszik szerepet, amit ez esetben az Asgard csoportba sorolnak az archeák B3 polimerázával együtt.[50]
η-, ι- és κ- (éta, ióta, és kappa) polimerázok[szerkesztés]
A Pol η (éta), Pol ι (ióta) és a Pol κ (kappa) a DNS-polimerázok Y családjába tartoznak, és a transzlációs szintézissel történő DNS-javításban vesznek részt. Rendre a POLH, POLI és POLK gének kódolják Az Y család tagjainak öt közös jellemzőjük van, amik segítenek a szubsztrát és a primer végének összekötésében, és mindegyiken jelen van a jobb kéz ujjaira és tenyerére hasonlító domének, további doménekkel egyetemben, mint például a polimeráz-asszociált domén (PAD) vagy a csukló. Viszont az aktív hely különbözik a család tagjai között, mert más léziókat javítanak. Az Y család polimerázai alacsony hitelességű polimerázok, de bebizonyult, hogy több a hasznuk, mint a káruk, mert a polimerázt érintő mutációk különböző betegségeket okozhatnak, például bőrrákot és xeroderma pigmentosumot. E polimerázok fontosságát jelzi, hogy a DNS-polimeráz η génjét XPV-nek nevezik, mert e gén elvesztése okozza a xeroderma pigmentosumot. A Pol η különösen fontos az ultraibolya sugárzás okozta DNS-károsodást követő transzléziós szintézist. A Pol κ funkciója nem teljesen ismert, de a kutatók találtak két valószínű funkciót. A Pol κ feltehetően bővítő vagy a DNS-lézióknál bázisbeillesztő. A három transzléziósszintézis-irányító polimeráz és a Rev1 a leállt replikációs DNS-polimerázok révén kerül a károsodott DNS-léziókra. A sérülés javításának két útvonala van, ami a kutatókat arra a következtetésre juttatta, hogy a választott útvonal a károsodott száltól függ.[51]
Rev1- és ζ- (zéta) polimerázok[szerkesztés]
A Pol ζ, a B-család egy másik polimeráza, két alegységből áll: a Rev3-ból, a katalitikus alegységből és a Rev7-ből (MAD2L2), ami a polimeráz katalízisét növeli, és a transzléziós szintézisben játszik szerepet. A Pol ζ-nak nincs 3’–5’-exonukleáz-aktivitása, és különlegességét az adja, hogy a primereket meg tudja hosszabbítani a terminális hibákkal. A Rev1-nek három érdekes régiója van: a BRCT-tartomány, az ubikvitinkötő tartomány és a C-terminális tartomány, és dCMP-transzferáz-képességgel rendelkezik, ami képes a dezoxicitidinnel szembeni léziókhoz is tud hozzátenni nukleotidokat, amik megállítanák a Pol δ-t és a Pol ε-t. Ezek a megakadó polimerázok aktiválják az ubikvitinkomplexeket, amik disszociálják a replikációs polimerázokat, és a Pol ζ-t és a Rev1-et asszociálják. A Pol ζ és a Rev1 hozzáteszik a dezoxicitidint és a Pol ζ a lézión túl megy. Egy ismeretlen folyamat szerint a Pol ζ disszociál, a replikációs polimerázok újra asszociálnak, és folytatják a replikációt. A Pol ζ és a Rev1 nem szükségesek a replikációhoz, de a REV3 gén elvesztése az élesztőben a DNS-t károsító ágensekre való megnövekedett érzékenységhez vezethet a replikációs villák összeomlása miatt, ahol a replikációs polimerázok megakadtak.[52]
Telomeráz[szerkesztés]
A telomeráz ribonukleoprotein, ami a lineáris kromoszómák végeit, a telomereket replikálja, amire a normál DNS-polimeráz nem képes. A kettős szálú kromoszóma egyszálú 3’-vége az 5’-TTAGGG-3’ sorozattal indítja el a telomerázt. A telomeráz a többi DNS-polimerázhoz hasonlóan hat, de a többi DNS-polimeráztól eltérően nem igényel templátot. A TERT alegység, a reverz transzkriptázok egyike, az RNS-alegységet használja fel a primer-templát kapcsolat kialakításához, ami lehetővé teszi a telomeráz számára a kromoszómavégek 3’-végeinek elongációját. A telomerek az élet folyamán tartó folyamatos csökkenését az öregedés hatásaival hozzák összefüggésbe.[14]
γ-, θ- és ν- (gamma, théta és nű) polimerázok[szerkesztés]
A Pol γ (gamma), Pol θ (théta) és a Pol ν (nű) a polimerázok A családjának tagjai. A POLG gén által kódolt Pol γ-t sokáig az egyetlen mitokondriális polimeráznak gondolták, 2014-es és 2017-es vizsgálatok szerint viszont az X családba tartozó Pol β is megtalálható a mitokondriumokban.[53][54] Bármilyen, korlátozott működésű vagy működésképtelen Pol γ-hoz vezető mutáció jelentős hatással van a mtDNS-re és az öröklött autoszomális mitokondriális rendellenességekre.[55] A Pol γ C-terminális polimerázdomént, N-terminális 3’–5’ exonukleázdomént, járulékos alegységet és az ezeket összekapcsoló régiót tartalmazza. A járulékos alegység kötődik a DNS-hez, és a Pol γ működéséhez szükséges. Az összekapcsoló régióban lévő A467T pontmutáció az összes Pol γ-val összefüggésbe hozható mitokondriális rendellenesség több mint egyharmadával hozható összefüggésbe.[56] Míg a Pol θ számos, a POLQ gén által kódolt homológja megtalálható eukariótákban, funkciója nem tisztázott. A C-terminális aminosav-szekvencia alapján az A családba tartozik a Pol θ, de a hibaaránya jobban hasonlít az Y családéira. A Pol θ a nem megfelelően párosított primerterminusokat hosszabbítja, és nukleotid hozzáadásával tud átugorni bázismentes helyeket. Ezenkívül dezoxiribonukleofoszfodiészterázként működhet a polimerázdoménben és ssDNS közelében ATPázként is működhet.[57] A DNS-polimeráz théta képes átírni az RNS-t DNS-re.[58]
A Pol ν-t (nű) tekintik a legkevésbé hatékony polimeráznak,[59] azonban szerepet játszik a homológiaalapú javításban a keresztkötésre való sejtválaszok során, amely szerepet a helikázzal alkotott komplexben tölt be.[59]
A növények két A-családbeli polimerázt használnak a mitokondriális és a plasztiszgenomok másolására. Ezek inkább hasonlítanak a baktériumok Pol I-ére, mint az emlősök Pol γ-jára.[60]
Reverz transzkriptáz[szerkesztés]
A retrovírusok (mint például a HIV) egy RNS-dependens DNS-polimerázt (RdDp), a reverz transzkriptázt kódolják, ami DNS-t szintetizál RNS-templátból. A reverztranszkriptáz-családban vannak DNS-polimerázok és az RNS-t DNS-sé lebontó RNáz H-k.[14]
A reverz transzkriptázt az RNS kutatási célú felerősítésére is használják. RNS-templát használatával a PCR is használhat reverz transzkriptázt DNS-templát készítésével. Ez a DNS-templát pedig felhasználható PCR-erősítésre. Egy ilyen kísérlet tehát RNS-ből felerősített PCR-eredményeket ad.[9]
Minden HIV retrovírus-részecske két RNS-genomot tartalmaz, de fertőzés után minden vírus csak egy provírust hoz létre.[61] Fertőzés után a reverz transzkripció mellett a két genom közt templátcsere (másolásválasztás-rekombináció) is történik.[61] 5–14 rekombináció történik genomonként minden replikációs ciklus során.[62] A templátcsere (rekombináció) a sérült genomok a genom integritása szempontjából szükséges javítómechanizmusa.[61][63]
T4 bakteriofág DNS-polimeráz[szerkesztés]
A T4 bakteriofág egy 5’–3’ irányú DNS-szintézist katalizáló DNS-polimerázt kódol.[64] A fág polimeráza ezenkívül 3’–5’ irányba ható exonukleázként is tud működni,[65] s ezt az újonnan behelyezett bázisok hibajavításban és szerkesztésében használja ki.[66] Egy hőérzékeny DNS-polimerázt tartalmazó fágon, ha a szaporodását lehetővé tevő hőmérsékleteken tenyésztették, a megfigyelések szerint kétszer gyakrabban ment végbe rekombináció, mint a nem tenyésztett fágok esetén.[67]
Feltételezések szerint a fág DNS-polimerázában végbemenő mutációs változás stimulálhatja a templátváltást a DNS-replikáció során.[67]
Kapcsolódó szócikkek[szerkesztés]
Jegyzetek[szerkesztés]
- ↑ F. J. Bollum (1960. augusztus). „Calf thymus polymerase”. The Journal of Biological Chemistry 235 (8), 2399–403. o. DOI:10.1016/S0021-9258(18)64634-4. PMID 13802334.
- ↑ A. Falaschi, A. Kornberg (1966. április 1.). „Biochemical studies of bacterial sporulation. II. Deoxy- ribonucleic acid polymerase in spores of Bacillus subtilis”. The Journal of Biological Chemistry 241 (7), 1478–82. o. DOI:10.1016/S0021-9258(18)96736-0. PMID 4957767.
- ↑ I. R. Lehman, M. J. Bessman, E. S. Simms, A. Kornberg (1958. július). „Enzymatic synthesis of deoxyribonucleic acid. I. Preparation of substrates and partial purification of an enzyme from Escherichia coli”. The Journal of Biological Chemistry 233 (1), 163–70. o. DOI:10.1016/S0021-9258(19)68048-8. PMID 13563462.
- ↑ C. C. Richardson, C. L. Schildkraut, H. V. Aposhian, A. Kornberg (1964. január). „Enzymatic synthesis of deoxyribonucleic acid. XIV. Further purification and properties of deoxyribonucleic acid polymerase of Escherichia coli”. The Journal of Biological Chemistry 239, 222–32. o. DOI:10.1016/S0021-9258(18)51772-5. PMID 14114848.
- ↑ H. K. Schachman, J. Adler, C. M. Radding, I. R. Lehman, A. Kornberg (1960. november 1.). „Enzymatic synthesis of deoxyribonucleic acid. VII. Synthesis of a polymer of deoxyadenylate and deoxythymidylate”. The Journal of Biological Chemistry 235 (11), 3242–9. o. DOI:10.1016/S0021-9258(20)81345-3. PMID 13747134.
- ↑ B. K. Zimmerman (1966. május 1.). „Purification and properties of deoxyribonucleic acid polymerase from Micrococcus lysodeikticus”. The Journal of Biological Chemistry 241 (9), 2035–41. o. DOI:10.1016/S0021-9258(18)96662-7. PMID 5946628.
- ↑ The Nobel Prize in Physiology or Medicine 1959. Nobel Foundation. (Hozzáférés: 2012. december 1.)
- ↑ I. Tessman, M. A. Kennedy (1994. február 1.). „DNA polymerase II of Escherichia coli in the bypass of abasic sites in vivo”. Genetics 136 (2), 439–48. o. DOI:10.1093/genetics/136.2.439. PMID 7908652.
- ↑ a b Lehninger principles of biochemistry, 6th, New York: W.H. Freeman and Company (2013. április 16.). ISBN 978-1-4292-3414-6. OCLC 824794893
- ↑ Garrett, Grisham. Biochemistry. Mary Finch (2013)
- ↑ W. N. Hunter, T. Brown, N. N. Anand, O. Kennard (1986). „Structure of an adenine-cytosine base pair in DNA and its implications for mismatch repair”. Nature 320 (6062), 552–5. o. DOI:10.1038/320552a0. PMID 3960137.
- ↑ M. K. Swan, R. E. Johnson, L. Prakash, S. Prakash, A. K. Aggarwal (2009. szeptember 1.). „Structural basis of high-fidelity DNA synthesis by yeast DNA polymerase delta”. Nature Structural & Molecular Biology 16 (9), 979–86. o. DOI:10.1038/nsmb.1663. PMID 19718023.
- ↑ A. T. Steitz (1999. június 1.). „DNA polymerases: structural diversity and common mechanisms”. The Journal of Biological Chemistry 274 (25), 17395–8. o. DOI:10.1074/jbc.274.25.17395. PMID 10364165.
- ↑ a b c d e R. Losick, J. D. Watson, T. A. Baker, S. Bell, A. Gann, M. W. Levine. Molecular biology of the gene, 6., San Francisco: Pearson/Benjamin Cummings (2008). ISBN 978-0-8053-9592-1
- ↑ D. McCarthy, C. Minner, H. Bernstein, C. Bernstein (1976. április 16.). „DNA elongation rates and growing point distributions of wild-type phage T4 and a DNA-delay amber mutant”. Journal of Molecular Biology 106 (4), 963–81. o. DOI:10.1016/0022-2836(76)90346-6. PMID 789903.
- ↑ J. Filée, P. Forterre, T. Sen-Lin, J. Laurent (2002. június 1.). „Evolution of DNA polymerase families: evidences for multiple gene exchange between cellular and viral proteins”. Journal of Molecular Evolution 54 (6), 763–73. o. [2020. július 29-i dátummal az eredetiből archiválva]. DOI:10.1007/s00239-001-0078-x. PMID 12029358. (Hozzáférés: 2021. augusztus 13.)
- ↑ a b c P. Raia, M. Carroni, E. Henry, G. Pehau-Arnaudet, S. Brûlé, P. Béguin, G. Henneke, E. Lindahl, M. Delarue, L. Sauguet (2019. 1). „Structure of the DP1-DP2 PolD complex bound with DNA and its implications for the evolutionary history of DNA and RNA polymerases”. PLOS Biology 17 (1), e3000122. o. DOI:10.1371/journal.pbio.3000122. PMID 30657780.
- ↑ E. M. Boehm, K. T. Powers, C. M. Kondratick, M. Spies, J. C. Houtman, M. T. Washington (2016. április 1.). „The Proliferating Cell Nuclear Antigen (PCNA)-interacting Protein (PIP) Motif of DNA Polymerase η Mediates Its Interaction with the C-terminal Domain of Rev1”. The Journal of Biological Chemistry 291 (16), 8735–44. o. DOI:10.1074/jbc.M115.697938. PMID 26903512.
- ↑ W. Yang (2014. május 1.). „An overview of Y-Family DNA polymerases and a case study of human DNA polymerase η” (angol nyelven). Biochemistry 53 (17), 2793–803. o. DOI:10.1021/bi500019s. PMID 24716551.
- ↑ G. Maga, U. Hubscher, S. Spadari, G. Villani. DNA Polymerases: Discovery, Characterization Functions in Cellular DNA Transactions. World Scientific Publishing Company (2010). ISBN 978-981-4299-16-9
- ↑ C. H. Choi, Z. F. Burton, A. Usheva (2004. február). „Auto-acetylation of transcription factors as a control mechanism in gene expression”. Cell Cycle 3 (2), 114–5. o. DOI:10.4161/cc.3.2.651. PMID 14712067. (Hozzáférés: 2016. április 7.)
- ↑ A. Chien, D. B. Edgar, J. M. Trela (1976. szeptember). „Deoxyribonucleic acid polymerase from the extreme thermophile Thermus aquaticus”. Journal of Bacteriology 127 (3), 1550–1557. o. DOI:10.1128/JB.127.3.1550-1557.1976. PMID 8432.
- ↑ a b M. Banach-Orlowska, I. J. Fijalkowska, R. M. Schaaper, P. Jonczyk (2005. október 1.). „DNA polymerase II as a fidelity factor in chromosomal DNA synthesis in Escherichia coli”. Molecular Microbiology 58 (1), 61–70. o. DOI:10.1111/j.1365-2958.2005.04805.x. PMID 16164549. (Hozzáférés: 2016. április 7.)
- ↑ InterPro protein view: P61875
- ↑ a b c K. S. Makarova, M. Krupovic, E. V. Koonin (2014. április 16.). „Evolution of replicative DNA polymerases in archaea and their contributions to the eukaryotic replication machinery”. Frontiers in Microbiology 5, 354. o. DOI:10.3389/fmicb.2014.00354. PMID 25101062.
- ↑ M. Rohe, K. Schrage, F. Meinhardt (1991. december 1.). „The linear plasmid pMC3-2 from Morchella conica is structurally related to adenoviruses”. Current Genetics 20 (6), 527–33. o. DOI:10.1007/BF00334782. PMID 1782679.
- ↑ M. W. Olson, H. G. Dallmann, C. S. McHenry (1995. december). „DnaX complex of Escherichia coli DNA polymerase III holoenzyme. The chi psi complex functions by increasing the affinity of tau and gamma for delta.delta' to a physiologically relevant range”. The Journal of Biological Chemistry 270 (49), 29570–7. o. DOI:10.1074/jbc.270.49.29570. PMID 7494000.
- ↑ Liao Y, Li Y, Schroeder JW, Simmons LA, Biteen JS (2016. december 1.). „Single-Molecule DNA Polymerase Dynamics at a Bacterial Replisome in Live Cells”. Biophysical Journal 111 (12), 2562–2569. o. DOI:10.1016/j.bpj.2016.11.006. PMID 28002733.
- ↑ a b c Xu ZQ, Dixon NE (2018. december 1.). „Bacterial replisomes”. Current Opinion in Structural Biology 53, 159–168. o. DOI:10.1016/j.sbi.2018.09.006. PMID 30292863.
- ↑ M. F. Goodman (2002). „Error-prone repair DNA polymerases in prokaryotes and eukaryotes”. Annual Review of Biochemistry 71, 17–50. o. DOI:10.1146/annurev.biochem.71.083101.124707. PMID 12045089.
- ↑ T. Mori, T. Nakamura, N. Okazaki, A. Furukohri, H. Maki, M. T. Akiyama (2012). „Escherichia coli DinB inhibits replication fork progression without significantly inducing the SOS response”. Genes & Genetic Systems 87 (2), 75–87. o. DOI:10.1266/ggs.87.75. PMID 22820381.
- ↑ D. F. Jarosz, V. G. Godoy, G. C. Walker (2007. április). „Proficient and accurate bypass of persistent DNA lesions by DinB DNA polymerases”. Cell Cycle 6 (7), 817–22. o. DOI:10.4161/cc.6.7.4065. PMID 17377496.
- ↑ M. Patel, Q. Jiang, R. Woodgate, M. M. Cox, M. F. Goodman (2010. június). „A new model for SOS-induced mutagenesis: how RecA protein activates DNA polymerase V”. Critical Reviews in Biochemistry and Molecular Biology 45 (3), 171–84. o. DOI:10.3109/10409238.2010.480968. PMID 20441441.
- ↑ M. D. Sutton, G. C. Walker (2001. július). „Managing DNA polymerases: coordinating DNA replication, DNA repair, and DNA recombination”. Proceedings of the National Academy of Sciences of the United States of America 98 (15), 8342–49. o. DOI:10.1073/pnas.111036998. PMID 11459973.
- ↑ a b Raychaudhury P, Basu AK (2011. március 1.). „Genetic requirement for mutagenesis of the G[8,5-Me]T cross-link in Escherichia coli: DNA polymerases IV and V compete for error-prone bypass”. Biochemistry 50 (12), 2330–8. o. DOI:10.1021/bi102064z. PMID 21302943.
- ↑ Madru C, Henneke G, Raia P, Hugonneau-Beaufet I, Pehau-Arnaudet G, England P, Lindahl E, Delarue M, Carroni M, Sauguet L (2020. március 1.). „Structural basis for the increased processivity of D-family DNA polymerases in complex with PCNA”. Nature Communications 11 (1), 1591. o. DOI:10.1038/s41467-020-15392-9. PMID 32221299.
- ↑ Y. Ishino, K. Komori, I. K. Cann, Y. Koga (1998. 4). „A novel DNA polymerase family found in Archaea”. Journal of Bacteriology 180 (8), 2232–6. o. DOI:10.1128/JB.180.8.2232-2236.1998. PMID 9555910.
- ↑ L. Sauguet, P. Raia, G. Henneke, M. Delarue (2016. április 16.). „Shared active site architecture between archaeal PolD and multi-subunit RNA polymerases revealed by X-ray crystallography”. Nature Communications 7, 12227. o. DOI:10.1038/ncomms12227. PMID 27548043.
- ↑ Yamasaki K, Urushibata Y, Yamasaki T, Arisaka F, Matsui I (2010. augusztus 1.). „Solution structure of the N-terminal domain of the archaeal D-family DNA polymerase small subunit reveals evolutionary relationship to eukaryotic B-family polymerases”. FEBS Letters 584 (15), 3370–5. o. DOI:10.1016/j.febslet.2010.06.026. PMID 20598295.
- ↑ Ishino S, Ishino Y (2014. április 16.). „DNA polymerases as useful reagents for biotechnology - the history of developmental research in the field”. Frontiers in Microbiology 5, 465. o. DOI:10.3389/fmicb.2014.00465. PMID 25221550.
- ↑ Koonin EV, Krupovic M, Ishino S, Ishino Y (2020. június 1.). „The replication machinery of LUCA: common origin of DNA replication and transcription”. BMC Biology 18 (1), 61. o. DOI:10.1186/s12915-020-00800-9. PMID 32517760.
- ↑ J. Yamtich, J. B. Sweasy (2010. május 1.). „DNA polymerase family X: function, structure, and cellular roles”. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1804 (5), 1136–50. o. DOI:10.1016/j.bbapap.2009.07.008. PMID 19631767.
- ↑ Marks' Basic Medical Biochemistry: a clinical approach, 4., Philadelphia: Wolter Kluwer Health/Lippincott Williams & Wilkins, chapter13. o. (2012). ISBN 978-1608315727
- ↑ Chung DW, Zhang JA, Tan CK, Davie EW, So AG, Downey KM (1991. december 1.). „Primary structure of the catalytic subunit of human DNA polymerase delta and chromosomal location of the gene”. Proceedings of the National Academy of Sciences of the United States of America 88 (24), 11197–201. o. DOI:10.1073/pnas.88.24.11197. PMID 1722322.
- ↑ Pursell ZF, Isoz I, Lundström EB, Johansson E, Kunkel TA (2007. július 1.). „Yeast DNA polymerase epsilon participates in leading-strand DNA replication”. Science 317 (5834), 127–30. o. DOI:10.1126/science.1144067. PMID 17615360.
- ↑ Lujan SA, Williams JS, Kunkel TA (2016. szeptember 1.). „DNA Polymerases Divide the Labor of Genome Replication”. Trends in Cell Biology 26 (9), 640–654. o. DOI:10.1016/j.tcb.2016.04.012. PMID 27262731.
- ↑ Johnson RE, Klassen R, Prakash L, Prakash S (2015. július 1.). „A Major Role of DNA Polymerase δ in Replication of Both the Leading and Lagging DNA Strands”. Molecular Cell 59 (2), 163–175. o. DOI:10.1016/j.molcel.2015.05.038. PMID 26145172.
- ↑ a b Doublié S, Zahn KE (2014. április 16.). „Structural insights into eukaryotic DNA replication”. Frontiers in Microbiology 5, 444. o. DOI:10.3389/fmicb.2014.00444. PMID 25202305.
- ↑ Edwards S, Li CM, Levy DL, Brown J, Snow PM, Campbell JL (2003. április 1.). „Saccharomyces cerevisiae DNA polymerase epsilon and polymerase sigma interact physically and functionally, suggesting a role for polymerase epsilon in sister chromatid cohesion”. Molecular and Cellular Biology 23 (8), 2733–48. o. DOI:10.1128/mcb.23.8.2733-2748.2003. PMID 12665575.
- ↑ Zaremba-Niedzwiedzka K, Caceres EF, Saw JH, Bäckström D, Juzokaite L, Vancaester E, Seitz KW, Anantharaman K, Starnawski P, Kjeldsen KU, Stott MB, Nunoura T, Banfield JF, Schramm A, Baker BJ, Spang A, Ettema TJ (2017. január 1.). „Asgard archaea illuminate the origin of eukaryotic cellular complexity” (angol nyelven). Nature 541 (7637), 353–358. o. DOI:10.1038/nature21031. PMID 28077874.
- ↑ Ohmori H, Hanafusa T, Ohashi E, Vaziri C. Separate roles of structured and unstructured regions of Y-family DNA polymerases, Advances in Protein Chemistry and Structural Biology, 99–146. o.. DOI: 10.1016/S1876-1623(08)78004-0 (2009). ISBN 9780123748270
- ↑ Gan GN, Wittschieben JP, Wittschieben BØ, Wood RD (2008. január 1.). „DNA polymerase zeta (pol zeta) in higher eukaryotes”. Cell Research 18 (1), 174–83. o. DOI:10.1038/cr.2007.117. PMID 18157155.
- ↑ R. Bienstock, W. Beard, S. Wilson (2014. augusztus). „Phylogenetic analysis and evolutionary origins of DNA polymerase X-family members”. DNA Repair 22, 77–88. o. DOI:10.1016/j.dnarep.2014.07.003. PMID 25112931.
- ↑ R. Prasad et al. (2017. október). „DNA polymerase β: A missing link of the base excision repair machinery in mammalian mitochondria”. DNA Repair 60, 77–88. o. DOI:10.1016/j.dnarep.2017.10.011. PMID 29100041.
- ↑ L. Zhang, S. S. Chan, D. J. Wolff (2011. július). „Mitochondrial disorders of DNA polymerase γ dysfunction: from anatomic to molecular pathology diagnosis”. Archives of Pathology & Laboratory Medicine 135 (7), 925–34. o. DOI:10.5858/2010-0356-RAR.1. PMID 21732785.
- ↑ J. D. Stumpf, W. C. Copeland (2011. január 1.). „Mitochondrial DNA replication and disease: insights from DNA polymerase γ mutations”. Cellular and Molecular Life Sciences 68 (2), 219–33. o. DOI:10.1007/s00018-010-0530-4. PMID 20927567.
- ↑ Hogg M, Sauer-Eriksson AE, Johansson E (2012. március 1.). „Promiscuous DNA synthesis by human DNA polymerase θ”. Nucleic Acids Research 40 (6), 2611–22. o. DOI:10.1093/nar/gkr1102. PMID 22135286.
- ↑ G. Chandramouly, J. Zhao, S. McDevitt, T. Rusanov, T. Hoang, N. Bosannik, T. Treddinick, F. W. Lopezcolorado, T. Kent, L. A. Siddique, J. Mallon, J. Huhn, Z. Shoda, E. Kashkina, A. Brambati, J. M. Stark, X. S. Chen, R. T. Pomerantz. „Polθ reverse transcribes RNA and promotes RNA-templated DNA repair”.
- ↑ a b UniProtKB - Q7Z5Q5 (DPOLN_HUMAN). Uniprot. (Hozzáférés: 2018. július 5.)
- ↑ J. D. Cupp, B. L. Nielsen (2014. november). „Minireview: DNA replication in plant mitochondria”. Mitochondrion 19 Pt B, 231–7. o. DOI:10.1016/j.mito.2014.03.008. PMID 24681310.
- ↑ a b c J. M. Rawson, O. A. Nikolaitchik, B. F. Keele, V. K. Pathak, W. S. Hu (2018. november). „Recombination is required for efficient HIV-1 replication and the maintenance of viral genome integrity”. Nucleic Acids Research 46 (20), 10535–10545. o. DOI:10.1093/nar/gky910. PMID 30307534.
- ↑ Cromer D, Grimm AJ, Schlub TE, Mak J, Davenport MP (2016. január). „Estimating the in-vivo HIV template switching and recombination rate”. AIDS (London, England) 30 (2), 185–92. o. DOI:10.1097/QAD.0000000000000936. PMID 26691546.
- ↑ Hu WS, Temin HM (1990. november 1.). „Retroviral recombination and reverse transcription”. Science 250 (4985), 1227–33. o. DOI:10.1126/science.1700865. PMID 1700865.
- ↑ M. Goulian, Z. J. Lucas, A. Kornberg (1968. február 10.). „Enzymatic synthesis of deoxyribonucleic acid. XXV. Purification and properties of deoxyribonucleic acid polymerase induced by infection with phage T4.”. J Biol Chem. 3 (243), 627–638. o. PMID 4866523. }}.
- ↑ W. M. Huang, I. R. Lehman (1972. május). „On the exonuclease activity of phage T4 deoxyribonucleic acid polymerase”. The Journal of Biological Chemistry 247 (10), 3139–46. o. DOI:10.1016/S0021-9258(19)45224-1. PMID 4554914.
- ↑ F. D. Gillin, N. G. Nossal (1976. szeptember). „Control of mutation frequency by bacteriophage T4 DNA polymerase. I. The CB120 antimutator DNA polymerase is defective in strand displacement”. The Journal of Biological Chemistry 251 (17), 5219–24. o. DOI:10.1016/S0021-9258(17)33149-6. PMID 956182.
- ↑ a b Bernstein H (1967. augusztus 1.). „The effect on recombination of mutational defects in the DNA-polymerase and deoxycytidylate hydroxymethylase of phage T4D”. Genetics 56 (4), 755–69. o. DOI:10.1093/genetics/56.4.755. PMID 6061665.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a DNA polymerase című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
- P. M. Burgers, E. V. Koonin, E. Bruford, L. Blanco, K. C. Burtis, M. F. Christman, W. C. Copeland, E. C. Friedberg, F. Hanaoka, D. C. Hinkle, C. W. Lawrence, M. Nakanishi, H. Ohmori, L. Prakash, S. Prakash, C. A. Reynaud, A. Sugino, T. Todo, Z. Wang, J. C. Weill, R. Woodgate (2001. november 1.). „Eukaryotic DNA polymerases: proposal for a revised nomenclature”. The Journal of Biological Chemistry 276 (47), 43487–43490. o. DOI:10.1074/jbc.R100056200. PMID 11579108.
- Unusual repair mechanism in DNA polymerase lambda, Ohio State Egyetem, 2006. július 25.
- Egy animáció a DNS-polimerázról a WEHI-től 1 perc 45 másodperctől Archiválva 2014. december 5-i dátummal a Wayback Machine-ben
- A DNS-polimeráz 3D-s makromolekuláris struktúrái az EM Data Banktól (EMDB)
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |

