Polihalogén-ionok
A polihalogén-ionok kizárólag halogénekből álló többatomos kationok és anionok. Ezek közt vannak egy halogénfajtát tartalmazó izo- és több halogénfajtát tartalmazó heteropolihalogén-ionok.
Fajtái[szerkesztés]
Számos polihalogén-ion ismert, melyek vegyületeit sikeresen izolálták és jellemezték. Az alábbi táblázatokban az ismert ionok vannak.[1][2][3][4][5][6]
| 2 atom | Cl+2,[* 1][2] Br+2, I+2 |
| 3 atom | Cl+3, Br+3, I+3 |
| 4 atom | Cl+4, I2+4 |
| 5 atom | Br+5, I+5 |
| 7 atom | I+7[* 2][1] |
| Több atom | I3+15 |
| 3 atom | ClF+2, Cl2F+, BrF+2, IF+2, ICl+2, IBrCl+, IBr+2, I2Cl+, I2Br+ |
| 5 atom | ClF+4, BrF+4, IF+4, I3Cl+2 |
| 7 atom | ClF+6, BrF+6, IF+6 |
| 3 atom | Cl−3, Br−3, I−3 |
| 4 atom | Br2−4, I2−4 |
| 5 atom | I−5 |
| 7 atom | I−7 |
| 8 atom | Br2−8, I2−8 |
| Több atom | I−9, I2−10, I4−10, I−11, I2−12, I3−13, I2−16, I2−22, I3−26, I4−26, I4−28, I3−29 |
| 3 atom | ClF−2, BrF−2, BrCl−2, IF−2, ICl−2, IBrF−, IBrCl−, IBr−2, I2Cl−, I2Br−, AtBrCl−, AtBr−2, AtICl−, AtIBr−, AtI−2 |
| 5 atom | ClF−4, BrF−4, IF−4, ICl3F−, ICl−4, IBrCl−3, I2Cl−3, I2BrCl−2, I2Br2Cl−, I2Br−3, I4Cl−, I4Br− |
| 6 atom | IF2−5 |
| 7 atom | ClF−6, BrF−6, IF−6, I3Br−4 |
| 9 atom | IF−8 |
- ↑ A Cl+2 csak Cl2O2+2-ként létezhet alacsony hőmérsékleten, mely töltésátvivő komplex az oxigén és a Cl+2 közt. A Cl+2 csak elektronikus sávspektruma révén ismert.
- ↑ A I+7 léte lehetséges, de bizonytalan.
Szerkezet[szerkesztés]

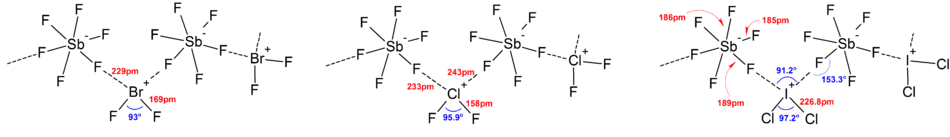


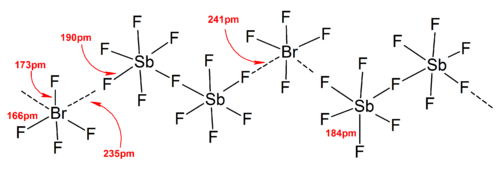
A legtöbb ion szerkezetét IR-, Raman-spektroszkópia vagy röntgenkrisztallográfia révén határozták meg. A polihalogén-ionokban mindig a legkevésbé elektronegatív és legnehezebb halogén van középen, így néha az ion aszimmetrikus. Például a Cl2F+ szerkezete [Cl–Cl–F]+, nem [Cl–F–Cl]+.
Általában a legtöbb hetero- és a kisebb izopolihalogén-ion szerkezete a VSEPR-modellnek megfelel. Azonban vannak kivételes esetek: ha a központi atom nehéz, és 7 magányos elektronpárja van, például a BrF−6 és IF−6 esetén, a fluoridligandumok szabályos oktaéderben rendeződnek el a sztereokémiailag inert magányos elektronpárok miatt. További eltérések találhatók a szilárd vegyületek szerkezeteiben erős kation-anion kölcsönhatások miatt, ez a vibrációs spektroszkópiai eredmények értelmezését nehezíti. Minden polihalogén-aniont tartalmazó sóban halogénhidak révén közel van az anion a kationhoz.[4] Például szilárd állapotban a IF−6 nem szabályos oktaéder, ami a (CH3)4NIF6-ban is megjelenik, ahol lazán kötött I2F2−11 dimerek vannak jelen. Jelentős kation-anion kölcsönhatások vannak a BrF2SbF6-ban, a ClF2SbF6-ban és a BrF4Sb6F11-ben is.[2]
| Lineáris vagy majdnem lineáris | ClF−2, BrF−2, BrCl−2, IF−2, ICl−2, IBr−2, I2Cl−, I2Br− |
| V alakú | ClF+2, Cl2F+, BrF+2, IF+2, ICl+2, I2Cl+, IBr+2, I2Br+, IBrCl+ |
| Négyzetes | ClF−4, BrF−4, IF−4, ICl−4 |
| Diszfenoid | ClF+4, BrF+4, IF+4 |
| Ötszög | IF2−5[* 1] |
| Oktaéder | ClF+6, BrF+6, IF+6, ClF−6,[7] BrF−6, IF−6 |
| Négyzetes antiprizma | IF−8 |
- ↑ Ez egyike a két XYn képletű ötszögletű ionnak, a másik a XeF−5.
A I3Cl+2 és I3Br+2 ionok transz-Z alakú szerkezete analóg a I+5-éval.
Nagyobb polijodidok[szerkesztés]
A polijodidionok szerkezete összetettebb. A diszkrét polijodidok általában lineáris jódatom- és jodidion-sorozatokból állnak, és a I2, I− és I−3 asszociáltjainak tekinthetők, ami a polijodidok eredetét mutatja. Szilárd állapotban a polijodidok kölcsönhathatnak egymással láncokat, gyűrűket vagy összetettebb 2 és 3 dimenziós hálózatokat alkotva.
Kötések[szerkesztés]
A polihalogén-ionok kötései nagyrészt a p-orbitálokat használják. Jelentős d-orbitál-részvétel valószínűtlen, mivel sok energia kell hozzá, és a jódvegyületekben némi s-orbitál-részvétel várható a hatástalanpár-hatás miatt Mössbauer-spektroszkópia alapján. Azonban egyetlen kötésmodell se tudta még a kötéshosszok és -szögek ily széles tartományát megmagyarázni.[3]
A X2 X+2-ná ionizálásakor egy elektron eltűnik a lazító orbitálról, így a kötésrend és -erősség nagyobb, az atomok távolsága kisebb a semleges X2-molekulához képest.
A lineáris vagy majdnem lineáris 3 atomos polihalogenidek kötései gyengébbek és hosszabbak a megfelelő kétatomos interhalogénhez vagy halogénhez képest, mely megfelel az atomok nagyobb taszításának, ahogy a halogenid a semleges molekulához kerül. A rezonanciaelméletet használó modell szerint például a ICl−2 tekinthető az alábbi formák rezonanciahibridjének:

Ezt erősítik a kötéshosszok (a ICl−2 esetén 255, a ICl(g) esetén 232 pm) és a kötésnyúlási hullámszámok (267 és 222 cm–1 a szimmetrikus, illetve aszimmetrikus nyúlásnál a ICl−2 esetén, 384 cm–1 a ICl esetén), ami alapján a ICl−2 kötéseinek rendje nagyjából 0,5, ami a rezonanciaelméletet használó értelmezésnek megfelel. Más XY−2 3 atomos ionok hasonlóan értelmezhetők.[2]
Bár kisebb a kötésrend, mindhárom halogén szorosan kapcsolódik. A trifluorid 0,5 kötésrendű F–F kötésének erőssége 30 kcal/mol, mindössze 8 kcal/mol-lal kisebb a kétatomos fluor 1 kötésrendű F–F kötésénél.[8]
Szintézis[szerkesztés]
A polihalogén-ionok a megfelelő interhalogének vagy halogének disszociációjának tekinthetők:
Polihalogén-kationok[szerkesztés]
A polihalogén-kationok szintézisére két gyakori módszer van:
- A megfelelő (inter)halogén reakciója Lewis-savval (például bór-, alumínium-, foszfor-, arzén-, antimon-halogenidek) inert vagy oxidáló oldószerrel vagy oldószer nélkül heteropolihalogén-kationt adva ()
- Oxidatív folyamattal, ahol a halogén vagy interhalogén oxidálószerrel és Lewis-savval reagál a kationt adva ()
Egyes esetekben a Lewis-sav (a fluoridakceptor) működik oxidálószerként:
Általában az első módszert használják heteropolihalogén-kationokhoz, és a második használható mindegyikre. Az oxidatív folyamat a IBr+2, ClF+6, BrF+6 kationok előállításához is használható, mivel a megfelelő interhalogének (IBr3, ClF7, BrF7) előállítása nem történt meg:
Egyes ilyen ionok szintézisét összegzi az alábbi táblázat egyenletekkel:[1][2][3][4]
| Ion | Megfelelő egyenlet | További feltételek |
|---|---|---|
| Cl+2 (Cl2O+2-ként) | vízmentes HF-ban alacsony hőmérsékleten | |
| Br+2 | szobahőmérsékleten | |
| I+2 | HOSO2F-ban | |
| Cl+3 | 195 K-en (–78 °C) | |
| Br+3 | ||
| I+3 | ||
| Cl+4 | vízmentes HF-ban, 193 K (–80 °C) alatti hőmérsékleten | |
| I2+4 | folyékony kén-dioxidban | |
| Br+5 | ||
| I+5 | ||
| I+7 | feltételezett | |
| ClF+2 | ||
| Cl2F+ | ||
| BrF+2 | többlet BrF3-dal | |
| IF+2 | ||
| ICl+2 | ||
| IBr+2 | ||
| ClF+4 | ||
| BrF+4 | ||
| IF+4 | ||
| ClF+6 | [* 1] | |
| BrF+6 | ||
| IF+6 |
Megjegyzések[szerkesztés]
- ↑ E reakcióban az aktív oxidálószer az in situ a Cs2NiF6/AsF5/HF rendszerben keletkező NiF+3. Ez erősebb oxidáló- és fluorozószer a platina-hexafluoridnál.
Polihalogén-anionok[szerkesztés]
Polihalogén-anionokhoz két általános előállítási módszer van:
- Interhalogén vagy halogén Lewis-bázissal való reakciójával:
- Egyszerű halogenidek oxidációjával:
Egyes ilyen ionok előállítását tartalmazza az alábbi táblázat egyenletekkel:[1][2][3][4]
| Ion | Reakció | További feltételek |
|---|---|---|
| X−3 (X = Cl, Br, I) | (X = Cl, Br, I) | |
| Br−3 | 1,2-diklóretánban vagy folyékony kén-dioxidban. Oldatban nincs Br−3, az csak kikristályosodáskor keletkezik. | |
| Br−5 | 1,2-diklóretánban vagy folyékony kén-dioxidban brómfelesleggel | |
| ClF−2 | ||
| BrCl−2[9]:v1p294 | ||
| ICl−2[9]:v1p295 | ||
| IBr−2[9]:v1p297 | ||
| AtXY− (X = I, Br, Cl; Y = I, Br) | (X = I, Br, Cl; Y = I, Br) | |
| ClF−4 | ||
| BrF−4 | BrF3-felesleggel | |
| IF−4 | 242 K-en keverve, majd 298 K-re hevítve | |
| ICl−4[9]:v1p298 | ||
| IF2−5 | ||
| IF−6 | ||
| I3Br−4 | ||
| IF−8 | acetonitrilben |
A nagyobb polijodidok bizonyos koncentrációjú I− és I2 oldatának kristályosításával keletkeznek. Például a KI3·H2O megfelelő mennyiségű I2 és KI telített oldatának hűtésekor kristályosodik ki.[9]:v1p294
Jellemzők[szerkesztés]
Stabilitás[szerkesztés]
Általában egy nagy kation vagy anion (például Cs+ és SbF−6) segíthet a polihalogén-ionok stabilizálásában, mivel a kitöltött tér nagyobb.
A polihalogén-kationok erős oxidálószerek, amit az is jelez, hogy csak oxidatív folyadékokban állíthatók elő. A legoxidatívabbak, így a leginstabilabbak a X+2 és a XF+6 , majd a X+3 és az IF+6.
A X+2-sók termodinamikailag stabilak. Azonban oldatban stabilitásuk az oldószertől függ. Például a I+2 fluor-antimonsavban (HF + 0,2 NSbF5, ) stabil, gyengébb fluoridakceptorok, például NbF5, TaF5 és NaF esetén I2-ra, I+3-ra és I+5-ra bomlik:[4]
Azonos kationok polihalogenidjei közül általában a nehezebb központi atomot tartalmazók stabilabbak, és a szimmetrikus ionok stabilabbak az aszimmetrikusaknál, így az anionok stabilitásának sorrendje:
3-nál nagyobb koordinációs számú heteropolihalogén-ionok csak fluoridligandumokkal léteznek.
Szín[szerkesztés]
A legtöbb polihalogén-ion intenzív színű, a nehezebb elemek sötétebb színűek. A keményítő-jód komplex az amilózba kerülő I−5 ionok miatt sötétkék.[4] Néhány gyakori ion színe:[3]
- a fluorokationok gyakran színtelenek vagy halványsárgák, más heteropolihalogén-ionok narancssárgák, vörösek vagy bíborszínűek[4]
- a ICl+2 vegyületei borvöröstől világos narancsig, a I2Cl+-éi sötétbarnától bíborfeketéig terjednek
- a Cl+3 sárga
- a Cl+4 kék[2]
- a Br+2 cseresznyevörös
- a Br+3 barna
- a Br+5 sötétbarna
- a I+2 világoskék
- a I+3 sötétbarna–fekete
- a I2+4 vörösbarna
- a I+5 zöld vagy fekete, a I5AlCl4 zöldesfekete tűkként jelenik meg vékony vörösbarna részekkel
- a I+7 fekete, ha a I7SO3F-ban való léte igazolva van
- a I3+15 fekete[5]
- a ICl−2 skarlátvörös
- a ICl−4 aranysárga
- a polijodidok nagyon sötétek, sötétbarnák vagy sötétkékek
Jellemzők[szerkesztés]
A heteropolihalogén-kationok robbanásszerűen reagálnak, gyakran a megfelelő interhalogéneknél reaktívabbak, és reduktív útvonalakon bomlanak. Mint a legmagasabb (+7) oxidációs számból is látható, a ClF+6, BrF+6 és IF+6 erős oxidálószerek, amit az alábbi reakciók mutatnak be:
Az alacsonyabb oxidációs számú polihalogén-kationok gyakran bomlanak. Például a Cl2F+ oldatban instabil, és gyorsan bomlik HF/SbF5-keverékben még 197 K-en is:
A I+2 reverzibilisen dimerizálódik 193 K-en, amit a paramágneses I+2 kék színéből a diamágneses I2+4 vörösbarna színébe való átmenet, a mágneses szuszceptibilitás és a vezetőképesség csökkenése jelez 193 K alatt:[2]
A dimerizáció oka a félig feltöltött π* orbitálok átfedése lehet a I+2-ban.
A Cl+4 a Cl4IrF6-ban a I2+4 analógja, de 195 K-en Cl2-ra és Cl+3-sókra bomlik.[2]
A ClF7 és BrF7 ClF+6 és BrF+6 ONF-dal való fluorozásával való előállítására tett kísérletek sikertelenek voltak, mert az alábbi reakciók történtek:[3]
Az anionok a kationoknál kevésbé reaktívak, és általában gyengébb oxidálószerek a megfelelő interhalogéneknél. Kevésbé reagálna szerves vegyületekkel, és egyes sóik nagyon hőstabilak. A képletű polihalogenidek, ahol , jellemzően monohalogenidjévé bomlanak, amelyben a halogén a legelektronegatívabb, így a monohalogenid rácsenergiája a lehető legnagyobb. A másik termék általában interhalogén. A 100 °C körül bomlik, és a -sók instabilak, és akár –31 °C-on is robbanhatnak.[4]
Jegyzetek[szerkesztés]
- ↑ a b c d King, R. Bruce. Chlorine, Bromine, Iodine, & Astatine: Inorganic Chemistry, Encyclopedia of Inorganic Chemistry, 2nd, Wiley, 747. o. (2005). ISBN 9780470862100
- ↑ a b c d e f g h i Chapter 17: The group 17 elements, Inorganic Chemistry, 3rd, Pearson, 547. o. (2008). ISBN 978-0-13-175553-6
- ↑ a b c d e f Greenwood, Norman N., Earnshaw, Alan. Chemistry of the Elements, 2nd, Butterworth-Heinemann, 835. o. (1997). ISBN 0-08-037941-9
- ↑ a b c d e f g h Advanced Inorganic Chemistry, 6th, Wiley (1999). ISBN 978-0471199571
- ↑ a b Inorganic Chemistry. Academic Press, 419–420. o. (2001). ISBN 0-12-352651-5
- ↑ (2020. február 4.) „Polyhalogen and Polyinterhalogen Anions from Fluorine to Iodine”. Angewandte Chemie International Edition 59 (14), 5464–5493. o. DOI:10.1002/anie.201903197. ISSN 1433-7851. PMID 31090163.
- ↑ Nem szabályos oktaéder alakú, mivel a hatástalanpár-hatás nem jelentős a klórnál.
- ↑ (2004) „What Makes the Trifluoride Anion F−3 So Special? A Breathing-Orbital Valence Bond ab Initio Study”. J. Am. Chem. Soc. 126 (45), 14890–14898. o. DOI:10.1021/ja046443a. PMID 15535716.
- ↑ a b c d e Handbook of Preparative Inorganic Chemistry, 2nd, New York: Academic Press (1963)
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Polyhalogen ions című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.



































































