Nyugalmi fMRI
A nyugalmi fMRI (Resting state fMRI, rsfMRI vagy R-fMRI) a funkcionális agyi képalkotó eljárások olyan formája, amellyel feltérképezhetjük az agyterületek közötti alapállapotú kapcsolatokat, vagyis azokat az összeköttetéseket, amik akkor figyelhetőek meg, amikor a vizsgálati személy nem végez konkrét, explicit feladatot.[1][2] Ez a nyugalmi aktivitás az agyi véráramlás változásán keresztül detektálható. A véráramlás fokozódása hozza létre a vér-oxigén-szint függő (blood-oxygen-level dependent), vagyis BOLD jelet, amit az fMRI (funkcionális mágneses rezonanciavizsgálat) vizsgálat során mérni tudunk. Mivel agyi aktivitás akkor is jelentkezik, ha nem adunk feladatot a személynek, így az agyterületek BOLD jel változásában spontán fluktuáció fogunk tapasztalni. A nyugalmi állapot vizsgálata igen hasznos lehet, általa feltérképezhetjük az agy funkcionális szerveződését és megvizsgálhatjuk, hogy vajon ez megváltozik-e különböző neurológiai vagy pszichiátriai zavarokban. A nyugalmi állapotú funkcionális konnektivitáshoz kapcsolódó kutatások feltártak számos olyan agyi hálózatot, amik mind megtalálhatók egészséges személyekben, a tudatosság különböző szintjein is megfigyelhetőek és jellegzetes szinkron aktivitás mintázat jellemező rájuk.[3][4][5]
Az fMRI alapjai
[szerkesztés]
A funkcionális mágneses rezonanciavizsgálat (funkcionális MRI vagy fMRI) az MRI-vizsgálat egy speciális típusa, amely az agyi aktivitást, annak véráramlás változásán keresztül detektálja. Vagyis az egyes agyterületek aktivitást a BOLD jel változásán keresztül tudjuk mérni.[6]
Az eljárás hasonló az MRI-vizsgálathoz, azonban az fMRI mérés alapja az oxigénben dús és az oxigénben szegény vér eltérő mágneses permeabilitása. Az aktív idegsejtek több glükózt és oxigént használnak fel, mint inaktív társaik. Az oxigént a vörösvértestekben lévő hemoglobin molekulák szállítják hozzájuk. Az aktiválódó agyterületeken tehát, a megnövekedett oxigén igény biztosítására fokozódik a véráramlás (hemodinamikus válasz), így az oxihemoglobin (Hb) és a dezoxihemoglobin (dHb) relatív aránya is megnő. Az oxihemoglobin és a dezoxihemoglobin eltérő mágneses tulajdonságokkal rendelkezik, a dezoxihemoglobin erősebben mágnesezhető, mint az oxihemoglobin, ami gyakorlatilag ellenáll ennek a hatásnak, és az MRI készülékkel ezt a jel különbséget tudjuk mérni. Az fMRI-t főként kutatásokban alkalmazzák, ugyanakkor kisebb számban klinikai vizsgálatokban is. Kiegészíthető és kombinálható más vizsgáló eljárásokkal, például EEG-vel és NIRS-sel (Near-infrared spectroscopy, közeli infravörös spektroszkópia).[7] A megjelölt spin technika (Arterial spin labeling fMRI, ASL) is hasznos lehet, mely során az artériákban lévő vízmolekulák protonjainak spinjét jelölik meg és ennek segítségével mérik az agyi véráramlást. Ez a módszer jól alkalmazható az idegrendszer nyugalmi állapotának még pontosabb felmérésében.[8]
Míg az fMRI igyekszik az idegsejtek aktivitását mérni az agyban, addig a BOLD jelet számos egyéb élettani hatás befolyásolhatja, nem csak a neuronális aktivitás. Ilyenek például a légzés ritmusának ingadozása és a szív-érrendszerben történő változások, amik hatással vannak az agyban mért BOLD jelre is. Ezért a nyers fMRI adatok feldolgozása során igyekszünk ezeket a zavaró tényezőket kiszűrni. Az fMRI kezdeti használatakor ezeknek az eltérő eredetű zajoknak köszönhetően sok szakértő szkeptikusan állt a nyugalmi fMRI elgondolásához. Az utóbbi időben azonban a kutatók (a különböző eljárásoknak és korrigálási lehetőségeknek köszönhetően) megbizonyosodhattak arról, hogy a mért intenzitás nem az egyéb élettani folyamatokból eredő artefaktum, hanem az agyterületek közötti nyugalmi állapotú funkcionális konnektivitás, amit jól tükröz ezen területek közös aktiválódási mintázata.[9]
Történeti áttekintés
[szerkesztés]Bharat Biswal
[szerkesztés]Bharat Biswal 1992-ben a Wisconsini Orvosi Egyetem végzős diákjaként kezdte meg munkáját mentora, James S. Hyde iránymutatásával. Ekkor fedezte fel, hogy az agy, még nyugalmi állapotában is hordoz információt funkcionális szerveződéséről, területei nem véletlenszerűen aktiválódnak, információáramlás zajlik közöttük. fMRI-t használt annak feltárására, hogy a különböző agyterületek, hogyan kommunikálnak egymással, miközben az agy nyugalomban van, és nem végez semmilyen konkrét aktivitást igénylő feladatot. Bár abban az időben Biswal kutatási eredményeit megkérdőjelezték és nagyrészt figyelmen kívül hagyták, manapság már a nyugalmi neuronális képalkotásra vonatkozó módszerét széles körben alkalmazzák, és megalapozott eljárásnak tekintik a funkcionális agyi hálózatok feltérképezésében. Az agyi aktivitás tanulmányozása nyugalmi helyzetben számos új lehetőséget rejt az idegrendszer kutatásában és segíthet az orvosoknak a különböző betegségek feltárásában.[1]
Marcus Raichle
[szerkesztés]A Washingtoni Orvosi Egyetemen végzett kutatási eredményeik alapján, Marcus E. Raichle neurológus és csapata kimutatta, hogy az agy energiafelhasználása a nyugalmi energiafogyasztás kevesebb, mint 5%-ával emelkedett meg, miközben a résztvevő egy erős koncentrálást igénylő mentális feladatot hajtott végre. Ezek a kísérletek igazolták, hogy az agyunkat folyamatos magas szintű aktivitás jellemzi, még akkor is, amikor nem végezünk komoly mentális feladatot (vagyis amikor az agyunk nyugalomban van). Kutatócsoportja elsősorban arra helyezte a hangsúlyt, hogy ennek a nyugalmi aktivitásnak az alapját feltárják és megalapozzák a további úttörő felfedezéseket. Ezek közé tartozik az fMRI technika fiziológiai alapjainak még pontosabb leírása, valamint a Nyugalmi Hálózat (Default Mode Network) felfedezése is. A Nyugalmi Hálózat agyterületek olyan rendszere, amely akkor aktív, amikor a személy relaxált, éber állapotban van és nem a külvilág ingereire figyel.[10]
Funkcionális és strukturális konnektivitás
[szerkesztés]Funkcionális konnektivitás
[szerkesztés]A funkcionális konnektivitás olyan agyterületek közötti kapcsolatot jelent, amelyek működésükben hasonlóak, kölcsönösen aktiválódnak és kiegészítik egymást bizonyos funkciók elvégzése közben. Úgy is megfogalmazhatjuk, mint a különböző neuropszichológiai eseményekhez kapcsolódó térben távoli, szétszórt neuroncsoportok és agyterületek közt meglévő kölcsönös időbeli kapcsolatot.[11] Ezeket az összeköttetéseket használják ki mind a nyugalmi állapothoz, mind pedig a feladatvégzéshez kapcsolódó kutatások. Amíg a funkcionális konnektivitás a résztvevők, az egyéni idői mintázatok, a különböző feladatok sorozatai, blokkjai vagy a próbák közti kapcsolatok feltárását célozza meg, addig a nyugalmi funkcionális konnektivitás az egyének között, nyugalmi állapotban jelentkező BOLD jel változások kapcsolataira összpontosít.[12] A területek közti funkcionális konnektivitást a vérátfolyás idejének mérésével, a perfúziós megjelölt spin fMRI technika segítségével is igyekeztek kimutatni.[13] Ezen kívül, alkalmazzák még a funkcionális konnektivitást vizsgáló MRI (fcMRI) eljárást, ami magában foglalja a nyugalmi fMRI és a feladat alapú MRI technikát is.[14] A funkcionális konnektivitás feltehetően a hálózatos működés egyfajta kifejeződése, ami részben a magasabb szintű kognitív működések alapjául szolgál, mert ellentétben a strukturális konnektivitással, a funkcionális kapcsolatok megváltozhatnak. A Dinamikus Funkcionális Konnektivitás (Dynamic functional connectivity) elmélet szerint ezek a kapcsolatok percek, vagy akár másodpercek alatt is átalakulhatnak, szemben a hagyományos elmélettel, mely szerint a funkcionális kapcsolatok időben stabilak. A változások több tényező miatt kialakulhatnak, ilyen például az alvás, a tanulás vagy valamilyen mentális feladat végzése és hatással lehetnek a viselkedésre is. Ezen kívül az akupunktúrás tűkből jövő szomatoszenzoros input és az elektromos idegi stimuláció is megváltoztatja a funkcionális konnektivitást a nyugalmi hálózatokban.[15]
Strukturális konnektivitás
[szerkesztés]Amikor az egyes agyterületek között fizikai, anatómiai kapcsolatokat is találunk, ezt nevezzük strukturális konnektivitásnak. Az agyterületek között nem kell anatómiai összeköttetéseknek lenniük ahhoz, hogy funkcionális kapcsolatban lehessenek és a strukturális konnektivitás nem jelentik feltétlenül azt, hogy a területek között funkcionális kapcsolat is fennáll.[16] Igen sok kezdeményezés, mint például az Emberi Konnektom Projekt (Human Connectome Project, HCP) tűzte ki céljául a konnektom, vagyis agyunk neurális kapcsolati térképének leírását, ami fényt deríthet az egészséges emberi idegrendszer anatómiai és a funkcionális kapcsolataira egyaránt.[17]
Agyi hálózatok
[szerkesztés]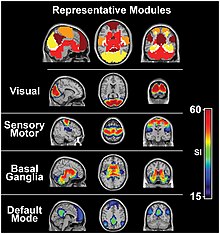
Nyugalmi Hálózat
[szerkesztés]A Nyugalmi Hálózat a leggyakrabban tanulmányozott, nyugalmi helyzetben aktív agyi hálózatok közé tartozik, valamint az egyik legkönnyebben megjeleníthető is.[18] A Nyugalmi- vagy Alap Hálózat (Default Mode Network, DMN) olyan agyi régiókból álló rendszer, ami abban az esetben lesz aktív, mikor a vizsgálati személy éber állapotban, nyugalmi helyzetben van. A Nyugalmi Hálózat anatómiailag jól körülhatárolt és szorosan összefüggő struktúra, akkor aktiválódik, ha a személy a belső folyamataira koncentrál, álmodozik, elképzeli a jövőt, emlékeket hív elő vagy felveszi mások perspektíváját. Magába foglalja a medio-temporális lebeny egy részét, ami az emlékezet szempontjából fontos, a mediális prefrontális kéreg egy részét, ami a tudatelméleti (theory of mind, ToM) működésben lényeges, az információ integrálásához a poszterior cinguláris kérget és a precuneus-t, valamint a mediális, laterális és inferior parietális kéreg területeit.[19] Negatív kapcsolatban áll olyan rendszerekkel, amik külső vizuális jelzésekre aktiválódnak, ebben az esetben a Nyugalmi Hálózat deaktiválódik.
Egyéb nyugalmi állapotban aktív hálózatok
[szerkesztés]A funkcionális konnektivitást vizsgáló tanulmányok az alkalmazott vizsgálati módszerektől függően, számos olyan neuronális hálózatot bemutattak, amik szoros kapcsolatban állnak a nyugalmi állapottal. Ezekhez a kulcsfontosságú hálózatokhoz tartozik a Nyugalmi Hálózat is, valamint a Szomatoszenzoros-Motoros Hálózat, a Végrehajtó Kontroll Hálózat, a Szaliencia Hálózat, a Dorzális Figyelmi Hálózat, a Bazális Ganglionok Hálózata, három különböző vizuális hálózat, két lateralizált frontális/parietális hálózat, az Auditoros Hálózat és a Temporális/Parietális Hálózat.[20] Ahogy már korábban is említettük, ezek a nyugalmi hálózatok anatómiailag elkülönült, viszont funkcionálisan szoros kapcsolatban lévő területekből állnak, ezen felül a BOLD jel aktivitásuk is erős összefüggést mutat. Tudományos kutatások alapján ezekről a hálózatokról elmondhatjuk, hogy az eltérő adatgyűjtési módoktól és elemzési módszerektől függetlenül, nagy állandóságot mutatnak.[21] Fontos megjegyezni, hogy a nyugalmi hálózatok komponensei ismert funkcionális hálózatokat alkotnak, olyan területeket, amelyek köztudottan, adott kognitív funkciók létrejöttében vesznek részt.[4]
Adatelemzés
[szerkesztés]Adatok feldolgozása
[szerkesztés]Sok program létezik a nyugalmi fMRI adatok feldolgozására és elemzésére. A leggyakrabban használt software-ek a következők: SPM, AFNI, FSL (különösen a Melodic az ICA-hoz), CONN és C-PAC.
Gyakori módszerek
[szerkesztés]Sokféle technika létezik a rsfMRI adatok rögzítésére és feldolgozására, de két elemzési módszer terjedt el leginkább az agyi funkcionális konnektivitás vizsgálatában.
Független komponens elemzés
[szerkesztés]A független komponens elemzés (Independent Component Analysis, ICA) hasznos statisztikai megközelítési mód a nyugalmi hálózatok detektálásában. Az ICA különválasztja a jelet átfedés mentes téri és idői részekre. Nagyrészt az adatoktól függ, hogy megengedik-e a jel zajos szakaszainak (légzésből, szívverésből, stb. eredő mozgások miatti torzulások) nagyobb mértékű eltávolítását. Az elemzésekkel az is kimutatták, hogy a megfelelően beazonosított Nyugalmi Hálózat, hasonlóan a többi idegi hálózathoz, nagy állandóságot mutat az egyének közt.[22]
Seed-based vagy Region of interest (ROI) módszer
[szerkesztés]Egy másik gyakori eljárás az agyban lévő hálózatok és kapcsolatok feltérképezésére a Kiemelés alapú, vagy Figyelt terület (ROI) elemzési mód. Ebben az esetben csak bizonyos, előre meghatározott voxelek vagy voxel csoportok (kiemelt vagy figyelt területek) jel intenzitását hasonlítsuk össze más területekből származó voxelek eredményeivel. Ez a megközelítés sokkal részletesebb és precízebb képet fest a számunkra fontos agyterületek közti összeköttetésekről.[23][24]
A nyugalmi hálózatok jellemzésére használt további eljárások lehetnek még: a parciális korreláció, a koherencia és parciális koherencia, funkcionális kapcsolatelemzés, fázis összekapcsolódás, klaszterezés és a gráf elmélet.[25][26]
Képalkotó eljárások kombinálása
[szerkesztés]fMRI és EEG
[szerkesztés]Igen sok, a képalkotó eljárásokban jártas tudós véli úgy, ahhoz, hogy az agyi aktivitás téri és idői változásáról a legtöbb információt megkaphassuk, szükség van mind az fMRI, mind az elektroenkefalográfia (EEG) egyidejű alkalmazására. Ez a kettős módszer megfelelően kombinálja az EEG azon képességét, hogy jó idői felbontással mutatja meg az idegi változásokat és láthatóvá teszi az esetleges patológiás mintázatokat, amellett az fMRI azon tulajdonságát, hogy jó téri felbontással képes megjeleníti a véráramlás dinamikáját az egész agyban. Mind a mai napig az EEG-fMRI technikára úgy tekintenek, mint egy olyan fMRI eljárásra, ahol az egyidejűleg szerzett EEG adatokat az agyi aktivitás („idegi változás”) idői jellemzésére használják, és ez teszi lehetővé a hozzájuk kapcsolódó hemodinamikus változások pontos kimutatását (például parametrikus statisztikai térképezéssel, statistical parametric mapping, SPM).[27]
A jelenleg is folyó kutatásokban részt vevő páciensek profitálnak leginkább ezekből a vizsgálati eredményekből, azonban friss kutatások szerint a nagyobb kapacitású és érzékenységű szkennerekkel végzett mérésekben megfelelő az EEG-fMRI-vizsgálatok megbízhatósága. Az EEG-fMRI mérést az epilepszia kutatásában és a kiváltott (külső inger által létrehozott) idegi válaszok vizsgálatában alkalmazzák. Ezen felül, az itt kapott eredmények új szempontot nyújthatnak a relaxált éber állapotban és alvás során megjelenő alap szintű agyi aktivitás tanulmányozásához.[28]
fMRI és TMS
[szerkesztés]Transzkraniális mágneses stimuláció (TMS) egy nem invazív eljárás, mely során mágneses teret hozunk létre és ennek segítségével pontosan ingereljük az agykéreg megfelelő régióit. Ahol a mágneses tér stimulálja az agykérget, ott a véráramlás fokozódik, valamint azokon a távolabbi területeken is, amik kapcsolatban állnak a kéreg ingerelt részével. Ebből kifolyólag, tehát a TMS-t felhasználhatjuk arra is, hogy még részletesebb információhoz jussunk a kapcsolatban álló agyi területekről. A kutatási eredmények hasonló kérgi területek között mutattak ki kapcsolatokat, mint az fMRI-vizsgálatokban, ami alátámasztja az agyi hálózatokról nyert eredményeket.[29]
Lehetséges buktatók
[szerkesztés]A funkcionális hálózatok meghatározása során, a rsfMRI használatakor is elképzelhető, hogy a BOLD jel a fentebb említett élettani tényezőknek köszönhetően (szívverés, a légzés[30][31] és a fej mozgásai[32][33][34][35]) zajossá válik. Amikor a vizsgálatvezetők rsfMRI-t használnak, elengedhetetlen, hogy tisztában legyenek ezekkel a zavaró tényezőkkel, mivel torzíthatják az eredményeket a feltételezett hatás irányába, különösen azokban a kutatásokban, ahol egészséges kontrollokhoz hasonlítják a páciensek eredményeit. Például előfordulhat, hogy a vizsgálatok során kisebb koherenciát találnak a Nyugalmi Hálózatban egy betegcsoport esetében, pedig csak többet mozogtak a szkennelés alatt és ez okozta az eltérést.
Jelenlegi és jövőbeni alkalmazás
[szerkesztés]A kutatásokban történő alkalmazás mellett a nyugalmi fMRI-nek nagy hasznát vehetik a klinikai vizsgálatokban, sok betegség és mentális zavar kialakulása, fejlődése, diagnosztizálása és terápiája során.[36] Mint például a szkizofrénia, a bipoláris zavar, a poszttraumás stressz zavar (PTSD) és a figyelemhiányos hiperaktivitás-zavar (Attention Deficit Hyperactivity Disorder, ADHD). Az eljárás a kómában lévő betegeknél is segíthet felmérni, hogy teljesen elveszítették-e kognitív képességeiket, vagy tudatosulnak számukra a külvilág ingerei, csak nem képesek reagálni rájuk. Valamint a műtéti altatások során is nyomon követhető lenne az agy reakciója és a tudatosság szintjének változása.
A nyugalmi funkcionális konnektivitásban jelentkező változások különböző betegségekben
[szerkesztés]A nyugalmi állapotú funkcionális konnektivitás megváltozását és átalakulását lehet tapasztalni Alzheimer kórban,[37] autizmusban,[38] depresszióban,[39][40][41] ADHD-ban,[42] epilepsziában,[43] Parkinson-kórban,[44] kényszerbetegségben (Obsessive Compulsive Disorder, OCD),[45] fájdalom szindrómában,[46][47] az öregedés során[37] valamint skizofréniában, ahol is a hálózatok szétesése figyelhető meg.[48]
A nyugalmi fMRI jelenlegi és más jellegű, jövőbeni klinikai alkalmazásai közé sorolható a csoportok közötti eltérések beazonosítása különböző idegrendszeri károsodások esetén, az eredményekből diagnosztikus információ kinyerése és a betegség prognózisának bejóslása, longitudinális kutatásokban a kezelések hatásának a felmérése, a betegségekhez társuló heterogén tünetek csoportosítása, valamint a műtétek, beavatkozások előzetes megtervezése a hálózatok feltérképezése által.[49] Mivel a nyugalmi állapot vizsgálatának nincsenek előzetes megkötései, így a kognitív érintettséggel rendelkező páciensek is könnyen vizsgálhatóak, képet kaphatunk az állapotukról.
Kapcsolódó szócikkek
[szerkesztés]- Agyi képalkotás
- Funkcionális agyi képalkotás
- Funkcionális mágneses rezonanciavizsgálat
- Eseményalapú funkcionális mágnesesrezonancia-vizsgálat
- Mágnesesrezonancia-képalkotás
- Strukturális MRI-vizsgálat
Jegyzetek
[szerkesztés]- ↑ a b Biswal, B. B. (2012). Resting state fMRI: A personal history. [Review]. Neuroimage, 62(2), p. 938-944.
- ↑ Buckner RL, Krienen FM, Yeo BT (2013). Opportunities and limitations of intrinsic functional connectivity MRI. Nature Neuroscience, 16(7), p. 832-837.
- ↑ Biswal, B. B. (2011). Resting State Functional Connectivity. Biological Psychiatry, 69(9), 200S-200S.
- ↑ a b Rosazza, C., & Minati, L. (2011). Resting-state brain networks: literature review and clinical applications. Neurol Sci, 32(5), 773-785.
- ↑ Cole, David M. & Smith, Stephen M. & Beckmann, Christian F. (2010) "Advances and pitfalls in the analysis and interpretation of resting-state FMRI data." Frontiers in systems neuroscience 4
- ↑ DeYoe, E. A., Bandettini, P., Neitz, J., Miller, D., & Winans, P. (1994). Functional magnetic resonance imaging (FMRI) of the human brain. J Neurosci Methods, 54(2), 171-187.
- ↑ Bandettini, P. (2007). Functional MRI today. Int J Psychophysiology, 63(2), 138-145.
- ↑ Chuang, KH. et al. (2008). Mapping resting-state functional connectivity using perfusion MRI. Neuroimage, 40(4), 1595-605
- ↑ Damoiseaux, J. S., Rombouts, S., Barkhof, F., Scheltens, P., Stam, C. J., Smith, S. M., et al. (2006). Consistent resting-state networks across healthy subjects. Proceedings of the National Academy of Sciences of the United States of America, 103(37), 13848-13853.
- ↑ Fox, M. D., Snyder, A. Z., Vincent, J. L., Corbetta, M., Van Essen, D. C., & Raichle, M. E. (2005). The human brain is intrinsically organized into dynamic, anticorrelated functional networks. Proceedings of the National Academy of Sciences of the United States of America, 102(27), 9673-9678.
- ↑ Biswal, B. B., VanKylen, J., & Hyde, J. S. (1997). Simultaneous assessment of flow and BOLD signals in resting-state functional connectivity maps. Nmr in Biomedicine, 10(4-5), 165-170.
- ↑ Friston, K. (2009). Causal Modelling and Brain Connectivity in Functional Magnetic Resonance Imaging. [Editorial Material]. Plos Biology, 7(2), 220-225.
- ↑ Fernandez-Seara, MA. (2011). Effects on resting cerebral blood flow and functional connectivity induced by metoclopramide: a perfusion MRI study in healthy volunteers. Br J Pharmacol, 163(8), 1639-52
- ↑ Smith, S. M. (2012). The future of FMRI connectivity. Neuroimage, 62(2), 1257-1266.
- ↑ Guerra-Carrillo, B.; Mackey, A. P.; Bunge, S. A. (21 February 2014). "Resting-State fMRI: A Window into Human Brain Plasticity". The Neuroscientist 20 (5): 522–533. doi:10.1177/1073858414524442
- ↑ Biswal, B. B., Mennes, M., Zuo, X. N., Gohel, S., Kelly, C., Smith, S. M., et al. (2010). Toward discovery science of human brain function. Proc Natl Acad Sci U S A, 107(10), 4734-4739.
- ↑ Van Essen, D. C., & Ugurbil, K. (2012). The future of the human connectome. [Review]. Neuroimage, 62(2), 1299-1310.
- ↑ Buckner, R. L. (2012). The serendipitous discovery of the brain's default network. Neuroimage, 62(2), 1137-1145.
- ↑ Greicius, M. D., Krasnow, B., Reiss, A. L., & Menon, V. (2003). Functional connectivity in the resting brain: A network analysis of the default mode hypothesis. Proceedings of the National Academy of Sciences of the United States of America, 100(1), 253-258.
- ↑ Moussa, M. N., Steen, M. R., Laurienti, P. J., & Hayasaka, S. (2012). Consistency of network modules in resting-state FMRI connectome data. PLoS One, 7(8), e44428.
- ↑ Lee, M. H., Hacker, C. D., Snyder, A. Z., Corbetta, M., Zhang, D. Y., Leuthardt, E. C., et al. (2012). Clustering of Resting State Networks. PLoS One, 7(7).
- ↑ Beckmann, C. F., DeLuca, M., Devlin, J. T., & Smith, S. M. (2005). Investigations into resting-state connectivity using independent component analysis. Philosophical Transactions of the Royal Society B-Biological Sciences, 360(1457), 1001-1013.
- ↑ Margulies, D. S., Kelly, A. M. C., Uddin, L. Q., Biswal, B. B., Castellanos, F. X., & Milham, M. P. (2007). Mapping the functional connectivity of anterior cingulate cortex. Neuroimage, 37(2), 579-588.
- ↑ Van Dijk KRA, Hedden T, Venkataraman A, Evans KC, Lazar SW, and Buckner RL (2010) Intrinsic Functional Connectivity As a Tool For Human Connectomics: Theory, Properties, and Optimization. Journal of Neurophysiology. 103: 297-321.
- ↑ Chang, C., & Glover, G. H. (2010). Time-frequency dynamics of resting-state brain connectivity measured with fMRI. Neuroimage, 50(1), 81-98.
- ↑ Faria, A. V., Joel, S. E., Zhang, Y. J., Oishi, K., van Zjil, P. C. M., Miller, M. I., et al. (2012). Atlas-based analysis of resting-state functional connectivity: Evaluation for reproducibility and multi-modal anatomy-function correlation studies. Neuroimage, 61(3), 613-621.
- ↑ Majeed, W., Magnuson, M., & Keilholz, S. D. (2009). Spatiotemporal Dynamics of Low Frequency Fluctuations in BOLD fMRI of the Rat. Journal of Magnetic Resonance Imaging, 30(2), 384-393.
- ↑ Keilholz, S. D., Magnuson, M., & Thompson, G. (2010). Evaluation of data-driven network analysis approaches for functional connectivity MRI. Brain Structure & Function, 215(2), 129-140.
- ↑ Fox, M. D., Halko, M. A., Eldaief, M. C., & Pascual-Leone, A. (2012). Measuring and manipulating brain connectivity with resting state functional connectivity magnetic resonance imaging (fcMRI) and transcranial magnetic stimulation (TMS). Neuroimage, 62(4), 2232-2243.
- ↑ Birn, R.M., Diamond, J.B., Smith, M.A., Bandettini, P.A., 2006. Separating respiratory-variation-related fluctuations from neuronal-activity-related fluctuations in fMRI. Neuroimage 31, 1536-1548.
- ↑ Chang, C., Glover, G.H., 2009. Relationship between respiration, end-tidal CO(2), and BOLD signals in resting-state fMRI. Neuroimage.
- ↑ Ing A, Schwarzbauer C (2012) A dual echo approach to motion correction for functional connectivity studies. NeuroImage 63: 1487–1497
- ↑ Van Dijk, K.R.A., Sabuncu, M.R., Buckner, R.L., 2012. The influence of head motion on intrinsic functional connectivity MRI. Neuroimage 59, 431-438.
- ↑ Power, J.D., Barnes, K.A., Snyder, A.Z., Schlaggar, B.L., Petersen, S.E., 2012. Spurious but systematic correlations in functional connectivity MRI networks arise from subject motion. Neuroimage 59, 2142-2154.
- ↑ Satterthwaite, T.D., Wolf, D.H., Loughead, J., Ruparel, K., Elliott, M.A., Hakonarson, H., Gur, R.C., Gur, R.E., 2012. Impact of in-scanner head motion on multiple measures of functional connectivity: relevance for studies of neurodevelopment in youth. Neuroimage 60, 623-632.
- ↑ Holtbernd, F., & Eidelberg, D. (2012). Functional brain networks in movement disorders: recent advances. Current Opinion in Neurology, 25(4), p. 392-401.
- ↑ a b Li, R., Wu, X., Chen, K., Fleisher, A. S., Reiman, E. M., & Yao, L. (2012). Alterations of Directional Connectivity among Resting-State Networks in Alzheimer Disease. AJNR Am J Neuroradiol.
- ↑ Müller, R-A., Shih, P., Keehn, B., Deyoe, J., Leyden, K., & Shukla, D. (2011). Underconnected but how? A survey of functional connectivity MRI studies in autism spectrum disorders. Cerebral Cortex, 21(10), 2233–2243.
- ↑ Anand A, Li Y, Wang Y, Wu J, Gao S, Kalnin A, et al. Activity and connectivity of mood regulating circuit in depression: a functional magnetic resonance study. Biological Psychiatry. 2005;15(10):1079-88.
- ↑ Greicius MD, Flores BH, Menon V, Glover GH, Solvason HB, Kenna H, et al. Resting-State Functional Connectivity in Major Depression: Abnormally Increased Contributions from Subgenual Cingulate Cortex and Thalamus. Biological Psychiatry. 2007;62(5):429-37.
- ↑ Anand A, Li Y, Wang Y, Lowe MJ, Dzemidzic M. Resting state corticolimbic connectivity abnormalities in unmedicated bipolar disorder and unipolar depression. Psychiatry Research-Neuroimaging. 2009;171(3):189-98.
- ↑ Uddin, L. Q., Kelly, A. M. C., Biswal, B. B., Margulies, D. S., Shehzad, Z., Shaw, D., et al. (2008). Network homogeneity reveals decreased integrity of default-mode network in ADHD. Journal of Neuroscience Methods, 169(1), 249-254.
- ↑ Wurina, Zang, Y. F., & Zhao, S. G. (2012). Resting-state fMRI studies in epilepsy. Neuroscience Bulletin, 28(4), 449-455.
- ↑ Tessitore, A., Amboni, M., Esposito, F., Russo, A., Picillo, M., Marcuccio, L., et al. (2012). Resting-state brain connectivity in patients with Parkinson's disease and freezing of gait. Parkinsonism & Related Disorders, 18(6), 781-787.
- ↑ Li, P., Li, S. F., Dong, Z. Y., Luo, J., Han, H. Y., Xiong, H. F., et al. (2012). Altered resting state functional connectivity patterns of the anterior prefrontal cortex in obsessive-compulsive disorder. Neuroreport, 23(11), 681-686.
- ↑ Otti A, Guendel H, Wohlschlager A, Zimmer C, Noll-Hussong M. Frequency shifts in the anterior default mode network and the salience network in chronic pain disorder. BMC Psychiatry. 2013;13:84.
- ↑ Otti A, Guendel H, Henningsen P, Zimmer C, Wohlschlaeger AM, Noll-Hussong M. Functional network connectivity of pain-related resting state networks in somatoform pain disorder: an exploratory fMRI study. J Psychiatry Neurosci. [Research Support, Non-U.S. Gov't]. 2013 Jan;38(1):57-65.
- ↑ Venkataraman, A., Whitford, T. J., Westin, C. F., Golland, P., & Kubicki, M. (2012). Whole brain resting state functional connectivity abnormalities in schizophrenia. Schizophrenia Research, 139(1-3), 7-12.
- ↑ Fox, M. D., & Greicius, M. (2010). Clinical applications of resting state functional connectivity. Front Syst Neurosci, 4, 19.
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a Resting state fMRI című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
