Ciklopropanon
| Ciklopropanon | |||
| |||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 5009-27-8 | ||
| PubChem | 138404 | ||
| ChemSpider | 122027 | ||
| |||
| |||
| InChIKey | VBBRYJMZLIYUJQ-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C3H4O | ||
| Moláris tömeg | 56.06326 | ||
| Megjelenés | színtelen | ||
| Sűrűség | 0,867 g/ml (25 °C) | ||
| Olvadáspont | −90 °C | ||
| Forráspont | 50–53 °C | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
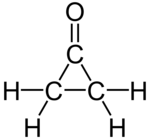
A ciklopropanon szerves vegyület, képlete (CH2)2CO. Az alapvegyület instabil, gyenge nukleofilokra is érzékeny. A ciklopropanon helyettesítésére ketálokat is használnak.[1]
Előállítás
[szerkesztés]A ciklopropanon ketén és diazomentán reakciójával állítható elő.[1][2] Ezen oldatok –78 °C-on stabilak. Protikus reagensek, például karbonsavak, primer és szekunder aminok vagy alkoholok jelenlétében a ciklopropanon gyakran szobahőmérsékleten izolálható adduktumokat képez:[3][4]
Szerkezet
[szerkesztés]A három szén és az oxigén egy síkban van. Mikrohullámú spektrum alapján a H2C–CH2 kötés különösen hosszú, 157,5 pm. Ezzel szemben a ciklopropán C–C kötése 151 pm. A C=O kötés 119 pm, rövidebb, mint az acetonban (123 pm).[1]
νC=O az infravörös spektrumban 1815 cm−1-nél van, az általános ketonokra jellemzőnél 70 cm−1-nel magasabb.
Származékai
[szerkesztés]A ciklopropanonok a ciklikus ketonok Favorszkij-átrendeződésének köztitermékei, ahol a karbonsavképződést gyűrűszűkülés kíséri.
A ciklopropanonok 1,3-dipólusokként reagálnak cikloaddíciókban ciklikus diénekkel, például furánnal.[1] Egy oxiallil-köztitermék vagy vegyérték-tautomer, vagy egy biradikális (vö. trimetilénmetán) lehet az aktív intermedier.
A ciklopropanonok további reakciói ezen intermedieren keresztül történnek. Például az enantiomertiszta (+)-transz-2,3-di-terc-butilciklopropanon 80 °C-on racemizálódik.[5]
Oxiallil-köztitermék játszhat szerepet egy 3,6-dihidro-4H-pirazol-4-on indánná való, nitrogéntávozással történő alakulásában:[6]
A fenti reakcióban az „A” oxiallil-köztitermék a „B” ciklopropanonnal egyensúlyban a fenilgyűrűt karbokationon keresztül reagál a fenilgyűrűvel tranziens „C” ciklohexa-1,3-diént adva (UV-nyoma hasonlít az izotoluolra), majd ismét aromás lesz. „A” és „B” energiakülönbsége 5-7 kcal/mol (21-29 kJ/mol).
Koprin
[szerkesztés]Az 1-aminociklopropanol a gombatoxin koprin hidrolízisével keletkezik. Ez az acetaldehid-dehidrogenáz inhibitora.[7]
Jegyzetek
[szerkesztés]- ↑ a b c d Wasserman, Harry H.. The Chemistry of Cyclopropanones, PATAI'S Chemistry of Functional Groups: Cyclopropyl Group, 1455–1532. o.. DOI: 10.1002/0470023449.ch23 (1987). ISBN 9780470023440
- ↑ Turro, Nicholas J. (1969). „Cyclopropanones”. Accounts of Chemical Research 2, 25–32. o. DOI:10.1021/ar50013a004.
- ↑ (1985) „Cyclopropanone Ethyl Hemiacetal from Ethyl 3-Chloropropanoate”. Organic Syntheses 63, 147. o. DOI:10.15227/orgsyn.063.0147.
- ↑ (1983) „Cyclopropanone Hemiacetals”. Chemical Reviews 83 (6), 619–632. o. DOI:10.1021/cr00058a002.
- ↑ Greene, Frederick D. (1970). „Thermal reactions of a cyclopropanone. Racemization and decarbonylation of trans-2,3-di-tert-butylcyclopropanone”. Journal of the American Chemical Society 92 (25), 7488. o. DOI:10.1021/ja00728a051.
- ↑ Moiseev, Andrey G. (2007). „First Direct Detection of 2,3-Dimethyl-2,3-diphenylcyclopropanone”. The Journal of Organic Chemistry 72 (8), 2777–2784. o. DOI:10.1021/jo062259r. PMID 17362038.
- ↑ Wiseman, Jeffrey S. (2002. május 1.). „Mechanism of inhibition of aldehyde dehydrogenase by cyclopropanone hydrate and the mushroom toxin coprine”. Biochemistry 18 (3), 427–435. o. DOI:10.1021/bi00570a006. PMID 369602.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Cyclopropanone című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.




