Szulfén
| Szulfén | |||
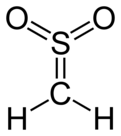 Vázképlet a hidrogének feltüntetésével |
 Kalottamodell | ||
| Más nevek | Metántion-dioxid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 917-73-7 | ||
| PubChem | 12244237 | ||
| ChemSpider | 10645700 | ||
| |||
| |||
| InChIKey | LZOZLBFZGFLFBV-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | CH2SO2 | ||
| Moláris tömeg | 78,090 g mol−1 | ||
| Kristályszerkezet | |||
| Molekulaforma | C-nél és S-nél trigonális planáris | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A szulfén reaktív vegyület, képlete H2C=SO2. Ez a szulfének (tial- és tioketon-S,S-dioxidok, általános képletük ) legegyszerűbb tagja.[1][2][3]
Előállítás
[szerkesztés]A szulfén köztitermék első általános módszere, melyről Gilbert Stork[4] és Günther Opitz is beszámoltak,[5] metánszulfonil-kloridból való hidrogén-klorid-elvonást használt trietilaminnal enamin csapdázószerrel. A tietán-1,1-dioxid-származék jelenléte a szulfén köztitermékre utalt. Mivel a szulfén erős elektrofil, az aminok használata nehézségeket okoz, mivel megszakíthatják a szulfént adduktumképzéssel. Egy aminhasználat nélküli egyszerű módszer a trimetilszililmetánszulfonil-klorid cézium-fluoridos deszililezését használja csapdázószer jelenlétében:[6]
Ezenkívül a szulfének aminoszubsztituensek alkilidénre helyezésével stabilizálhatók. A legegyszerűbb ilyen vegyület a síkalkatú amincsoportokat tartalmazó tiokarbamid-dioxid.

A tiokarbamid-dioxid ((H2N)2CSO2) szerkezete. A S=O kötés hossza 1,31, a S=C-é 1,85, a C-N-é 1,31 Å, a S körüli szögek 112°-osak.[7]
Reakciók
[szerkesztés]A szulfének reagálnak enaminokkal, inaminokkal és ciklopenta-1,3-diénekkel tietánokat, tieteket, illetve Diels–Alder-adduktumokat adva. Királis tercier amin esetén egyes szulfének klorállal (triklóracetaldehid) csapdázhatók katalitikus aszimmetrikus β-szulfon-szintézisben (4 tagú gyűrűs szulfonátészterekkel).[8] A szulfén inzertálódhat fém-hidrogén kötésekbe.[9]
Jegyzetek
[szerkesztés]- ↑ sulfenes, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ Zwanenburg, B (2004). „S,S-Dioxides of Thioaldehydes and Thioketones (Sulfenes and Derivatives)”. Sci. Synth. 27, 123–134. o.
- ↑ King, JF (1975). „Return of Sulfenes”. Acc. Chem. Res. 8 (1), 10–17. o. DOI:10.1021/ar50085a002.
- ↑ Stork, G (1962). „Four-membered Sulfones from Enamines and Aliphatic Sulfonyl Halides”. J. Am. Chem. Soc. 84 (2), 313. o. DOI:10.1021/ja00861a042.
- ↑ Opitz, G (1962). „Cycloaddition of Sulfenes to Enamines”. Angew. Chem. Int. Ed. 1 (2), 113–114. o. DOI:10.1002/anie.196201133.
- ↑ Block, E (1982). „A New Sulfene Synthesis”. Tetrahedron Lett. 23 (41), 4203–4206. o. DOI:10.1016/S0040-4039(00)88704-3.
- ↑ R. A. L. Sullivan (1962). „The Crystal and Molecular Structure of Thiourea Dioxide”. Acta Crystallogr. 15, 675–682. o. DOI:10.1107/S0365110X62001851.
- ↑ Koch, FM (2011). „Lewis Acid/Base Catalyzed [2+2]-Cycloaddition of Sulfenes and Aldehydes: A Versatile Entry to Chiral Sulfonyl and Sulfinyl Derivatives”. Chem. Eur. J. 17, 3679–3692. o. DOI:10.1002/chem.201003542.
- ↑ Ingo-Peter Lorenz (1978. április 1.). „Demonstration of "Sulfene" Insertion into the Metal–Hydrogen Bond”. Angew. Chem. Int. Ed. 17 (4), 285–286. o. DOI:10.1002/anie.197802851.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Sulfene című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.



