Nitrének

A nitrének vagy imének (RṄ:) a karbének nitrogénanalógjai. A nitrogén töltetlen és 1 vegyértékű,[1] így 6 vegyértékelektronja van, ebblől 2 kötő és 4 nem kötő. Ezért elektrofilek a nem teljes oktettől. A nitrének gyakran köztitermékek sok reakcióban.[2][3] A legegyszerűbb nitrént (HN) gyakran egyszerűen nitrénnek nevezik.[4]
Elektronszerkezet[szerkesztés]
A legegyszerűbb nitrénben a nitrogén hibridizációja sp, ahol a 4 nem kötő elektronból 2 magányos párt alkot egy sp pályán, 2 két elfajult p-pályán van. Az elektronszerkezet a Hund-szabálynak megfelel: az alacsony energiájú állapot triplett, ahol e két elektron eltérő pályán van, a nagyobb energiájú a szingulett, ahol egy p-pályán van a két elektron, feltöltve azt, a másik pálya üres.
A karbénekhez hasonlóan erős a korreláció az in silico a nitrogénen számítható spinsűrűség és a D nullmező-elválasztási paraméter közt, mely elektron-spinrezonancia révén számítható. [5] A kis nitrének, például az NH vagy az NCF3 esetén D közel 1,8 cm−1 2-höz közeli spinsűrűséggel. Alacsony (0,4 alatti) D jellemző a 9-antril- és a 9-fenantrilnitrénre.
Keletkezés[szerkesztés]
A nitréneket reakciókészségük miatt nem izolálják. Ehelyett reakciók köztitermékeként keletkeznek. Két gyakori mód van a nitrének előállítására:
- Azidok termo- vagy fotolízisekor nitrogén keletkezésével, a karbének diazovegyületekből való előállításához hasonlóan.
- Izocianátokból szén-monoxid keletkezésével. Ez a karbének keténekből való keletkezéséhez hasonlít.
Reakciók[szerkesztés]
A nitrének reakciói közé tartoznak:
- Nitrén-C–H-inzertáció. A nitrén C-H kötésbe kerülhet, amint vagy amidot létrehozva. A szingulett nitrénekben a szerkezet változatlan. Egy tanulmányban[6] karbamát kálium-perszulfátos oxidáció a Pd-N kötésbe kerül a palládium(II)-acetát és a 2-fenilpiridin közt metil-N-(2-piridilfenil)karbamátot adva kaszkádreakcióban.

Egy oximot és ecetsav-anhidridet tartalmazó, izoindol-származékot adó C-H inzertációban nitrén köztitermék fordulhat elő:[7]
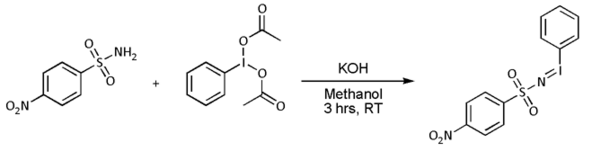
- Nitrén-cikloaddíció: alkénekkel a nitrének aziridint adnak, gyakran nitrenoid prekurzorokkal (például PhI=NNs vagy PhI=NTs), de ez közvetlenül szulfonamiddal történik átmenetifém-, például Cu-, Pd- vagy Au-alapú katalizátorral:[8][9][10][11][* 1]
Gyakran az [N-(p-benzolszulfonil)imino]feniljodinán (PhI=NNs) így keletkezik:
Ezután jön a nitréntranszfer:
Itt a cisz- és a transz-sztilbén is transz-aziridint ad, ez alapján feltehetően kétlépéses a reakció. A triplett és szingulett nitrének energiakülönbsége kicsi is lehet, átmenetet lehetővé téve. A triplett nitrének termodinamikailag stabilabbak, de lépésenként reagálnak szabad forgású sztereokémiai keveréket adva.[12]
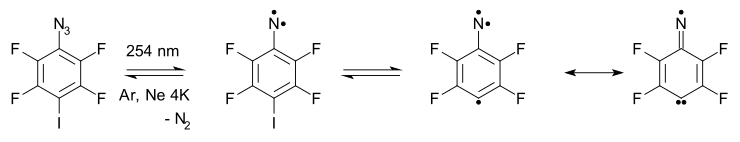
Arilnitrén-gyűrűbővülés és -szűkülés: Az arilnitrének 7 tagú kumulénekké bővülhetnek, gyűrűjük felnyílhat, és nitrilt képezhetbekcsok összetett reakcióban. Például az alábbi reakcióban az argonban lévő azid fotolízise 20 kelvinen triplett nitrénné és nitrogénné bomlik, amely egy nagyobb gyűrűjű termékkel van egyensúlyban.[5]
A nitrén végül nyílt láncú nitrilt képez diradikális köztitermékkel. Magas hőmérsékleten 65%-ban is nitril keletkezik.[* 2]
Nitrenogyökök[szerkesztés]
Egyes nitrén- és gyökcsoportot tartalmazó vegyületekre ismert ESR magas spinű kvartett alacsony hőmérsékletű mátrixban. Ezek egyike amin-oxid gyök,[13] egy másikban a gyök szénatomoncvan.[14]
E rendszerben a nitrogén egyik páratlan elektronja delokalizált, σ–σ–π triradikálist adva. A karbén-nitrogén (imidil) gyök az elektronszerkezetet befolyásolja.
2019-ben nagy ligandumhoz kötődő rézzel stabilizált triplett nitrént izoláltak Betley és Lancaster.[15]
A gyógyászatban[szerkesztés]
Egyes adamantilnitrének használhatók lehetnek influenza A-, influenza B-, 3-as típusú parainfluenza- és HIV-1-vírusok ellen.[16]
Megjegyzések[szerkesztés]
- ↑ A sztilbén kiindulási anyag, a p-nitrobenzolszulfonamid, a nozilát prekurzor, melyet a jodozobenzol-diacetát oxidál. Az aranyalapú katalizátor terpiridin ligandumot tartalmaz.
- ↑ A kinazolin a megfelelő bromidból és nátrium-azidból keletkezik. Az azid a tetrazollal egyensúlyban van.
Hivatkozások[szerkesztés]
- ↑ nitrenes, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ Nitrenes. New York: Interscience (1970. április 17.)
- ↑ Wentrup, C.. Reactive Intermediates. New York: Wiley (1984)
- ↑ imidogens, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ a b (2006. április 17.) „Nitrenes, Diradicals, and Ylides. Ring Expansion and Ring Opening in 2-Quinazolylnitrenes”. J. Org. Chem. 71 (11), 4049–4058. o. DOI:10.1021/jo052541i. PMID 16709043.
- ↑ (2006. április 17.) „Intermolecular Amidation of Unactivated sp2 and sp3 C–H Bonds via Palladium-Catalyzed Cascade C–H Activation/Nitrene Insertion”. J. Am. Chem. Soc. 128 (28), 9048–9049. o. DOI:10.1021/ja062856v. PMID 16834374.
- ↑ (2007. április 17.) „Novel Intramolecular Reactivity of Oximes: Synthesis of Cyclic and Spiro-Fused Imines”. Org. Lett. 9 (6), 981–983. o. DOI:10.1021/ol0630043. PMID 17319674.
- ↑ (2006. április 17.) „Nitrene Transfer Reactions Catalyzed by Gold Complexes”. J. Org. Chem. 71 (16), 5876–5880. o. DOI:10.1021/jo060016t. PMID 16872166.
- ↑ (1994. április 17.) „Development of the Copper-Catalyzed Olefin Aziridination Reaction”. J. Am. Chem. Soc. 116 (7), 2742–2753. o. DOI:10.1021/ja00086a007.
- ↑ (2000. április 17.) „Mechanistic Studies of Copper-Catalyzed Alkene Aziridination”. J. Am. Chem. Soc. 122 (33), 8013–8020. o. DOI:10.1021/ja993246g.
- ↑ (2006) „Advances in Nitrogen Transfer Reactions Involving Aziridines”. Acc. Chem. Res. 39 (3), 194–206. o. DOI:10.1021/ar050038m. PMID 16548508.
- ↑ Aziridines and Epoxides in Organic Synthesis, 120. o. (2007. április 17.). ISBN 978-3-527-31213-9
- ↑ (2001. május 30.) „Heterospin organic molecules: nitrene–radical linkages”. Polyhedron 20 (11–14), 1647–1652. o. DOI:10.1016/S0277-5387(01)00667-2.
- ↑ (2008. április 17.) „2,3,5,6-Tetrafluorophenylnitren-4-yl: Electron Paramagnetic Resonance Spectroscopic Characterization of a Quartet-Ground-State Nitreno Radical”. J. Am. Chem. Soc. 130 (13), 4396–4403. o. DOI:10.1021/ja078171s. PMID 18327939.
- ↑ Carsch, K. M. (2019). „Synthesis of a Copper-Supported Triplet Nitrene Complex Pertinent to Copper-Catalyzed Amination”. Science 365 (6458), 1138–1143. o. DOI:10.1126/science.aax4423. PMID 31515388.
- ↑ Kesel AJ, Weiss H-C, Schönleber A, Day CW, Barnard DL, Detorio MA, Schinazi RF (2012. december 7.). „Antiviral agents derived from novel 1-adamantyl singlet nitrenes”. Antivir Chem Chemother 23 (3), 113–128. o. DOI:10.3851/IMP2485. PMID 23234699. (Hozzáférés: 2023. december 23.)
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Nitrene című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.