E1cB-eliminációs reakció

Az E1cB-eliminációs reakció az eliminációs reakciók azon típusa, amely bázikus körülmények között megy végbe, és melynek során egy különösen rosszul távozó csoport (például −OH vagy −OR) és egy savas hidrogén eliminációjával alakul ki egy további kötés. Az E1cB három lépésből álló folyamat. Az első lépésben a bázis a legsavasabb proton leszakításával stabilizált aniont hoz létre. Az anion nemkötő elektronpárja a szomszédos atomra kerül át, kilökve onnan a távozó csoportot és kettős vagy hármas kötést alakítva ki.[1] A reakció elnevezése: unimolekulás konjugált bázison keresztül lejátszódó elimináció (angolul Elimination Unimolecular conjugate Base, E1cB). Az elimináció utal arra, hogy a mechanizmus eliminációs reakció, melynek során két szubsztituens távozik. Az unimolekulás azt jelenti, hogy a reakció sebességmeghatározó lépésében csak egyetlen molekula entitás játszik szerepet, végül a konjugált bázis a karbanion köztitermék képződésére utal, amely a reakció kiindulási anyagának konjugált bázisa.
Mechanizmus[szerkesztés]

Ahhoz, hogy egy reakció az E1cB-mechanizmus szerint mehessen végbe, két fő követelménynek kell teljesülnie. A vegyület β-szénatomjához savas hidrogénnek kell kapcsolódnia, az α-szénatomon pedig viszonylag rossz távozó csoport jelenléte szükséges. Az első lépésében a β-szénatom deprotonálódik, így anionos átmeneti állapot, például karbanion alakul ki. Minél stabilabb ez az átmeneti állapot, annál inkább kedvezményezett az E1cB-mechanizmus. Az átmeneti állapotot indukciós vagy mezomer hatások stabilizálhatják. Általánosságban elmondható, hogy a szubsztráton levő elektronszívó csoport, az erős bázis, a rossz távozó csoport és a poláris oldószer E1cB-mechanizmust eredményez. Stabil átmeneti állapottal bíró E1cB-mechanizmusra példa a földi légkörben viszonylag rövid felezési idővel rendelkező etiofenkarb karbamát rovarirtó bomlása. Az amin deprotonálásával keletkező amid – a szomszédos karbonilcsoporttal való konjugáció miatt – viszonylag stabil. A β-szénatomon található savas hidrogénen kívül viszonylag rossz távozó csoport is szükséges. Egy jó távozó csoport még a molekula ionizálása előtt kilépne, ami E2-mechanizmust valószínűsítene. Rossz távozó csoportot tartalmazó, és így E1cB-mechanizmusra képes vegyületek például az alkoholok és fluoralkánok. Felmerült, hogy az E1cB-mechanizmus gyakoribb az alkének körében (ekkor alkin keletkezik), mint az alkánoknál (melyek alkénné alakulnak).[2] Ennek egyik lehetséges magyarázata az, hogy az sp2 hibridizáció valamivel savasabbá teszi a hidrogéneket. Azt is meg kell azonban jegyezni, hogy ez a mechanizmus nem korlátozódik csak a szénatomról történő eliminációra. Heteroatomok esetében is megfigyelték, ilyen például a nitrogéntartalmú etiofenkarból történő fenolszármazék eliminációja.[3]

Az E1cB-elimináció megkülönböztetése az E1- és E2-eliminációs reakcióktól[szerkesztés]
A β-eliminációs reakciók során két szubsztituens távozik egy vegyület két szomszédos atomjáról. Termékként alkén, alkin, vagy ezek heteroatomos változatai (például karbonil vagy nitril) keletkezik. Az E1cB-mechanizmuson kívül további eliminációs reakciók is léteznek, ezek közül a legfontosabbak az E1- és E2-reakciók. Habár ezek mechanizmusa hasonló, abban különböznek egymástól, hogy mikor történik az α-szénatom deprotonálódása és a távozó csoport kilépése. Az E1 rövidítés unimolekulás eliminációt, az E2 bimolekulás eliminációt jelöl. Az E1-mechanizmusban a molekulában jó távozó csoport található, amely már az α-szénatom deprotonálódása előtt kilép. Köztitermékként így karbokation keletkezik, mely deprotonálódik, ennek eredményeként új π-kötés alakul ki. A molekulában jó távozó csoportnak – például bróm vagy klór – kell lennie, és az α-szénatom hidrogénje viszonylag kevéssé lehet savas.

Az E2-elimináció során mind az α-szénatom deprotonálódása, mind a távozó csoport kilépése egyszerre, egy koncertáló lépésben történik. Az E1-mechanizmushoz képest az E2-mechanizmust követő molekulákban az α-szénatom savasabb, de nem annyira, mint az E1cB-eliminációval átalakuló molekuláké. Az E2 és E1cb út között a fő különbség az, hogy utóbbi esetben nem egy lépéses a folyamat, hanem külön karbanion köztitermék alakul ki. Kísérletileg kimutatták, hogy különböző halogénatomok esetén eltérő a reakcióút. Az egyik példában fluor helyett a karbaniont jobban stabilizáló halogén, klór szerepel,[4] így – bár a klór a fluornál sokkal jobb távozó csoport – a fluor fog kilépni.[5] Ez bizonyítja, hogy azért keletkezik karbanion, mert a legstabilabb koncertáló E2-mechanizmussal nem tud keletkezni a termék. Az alábbi táblázat összefoglalja a háromféle eliminációs reakció közötti fő különbségeket, ugyanakkor annak meghatározása, hogy egy bizonyos reakció mely mechanizmus szerint játszódik le, nem nélkülözheti a reakciókinetikai vizsgálatokat.
| E1 | E2 | E1cB |
|---|---|---|
| többlépéses reakció | koncertáló reakció | többlépéses reakció |
| karbokation köztitermék | egyidejű a proton eltávolítása, a kettős kötés kialakulása és a távozó csoport kilépése | karbanion köztitermék |
| nincs konklúzió | nincs preferencia | nincs konklúzió |
| jó távozó csoport | távozó csoport | rossz távozó csoport |
| kevéssé savas B−H | savas B−H | savasabb B−H |
Az E1cB-eliminációs mechanizmusok reakciókinetikája[szerkesztés]
Annak megállapításához, hogy egy reakció E1cB-mechanizmus szerint megy-e végbe, nélkülözhetetlen a reakciókinetika alkalmazása. Az E1cB-mechanizmus azonosításának legbiztosabb módja a sebességi egyenletek és a kinetikus izotópeffektus vizsgálata. Ezek a módszerek alkalmasak az E1cB-, E1- és E2-elimációs reakciók megkülönböztetésére is.
Sebességi egyenlet[szerkesztés]
A reakciókinetikai vizsgálatok alapvető fontosságúak, amikor kísérletileg próbálják meghatározni, hogy egy reakció E1cB-mechanizmust követ-e. Az E1cB-mechanizmus azonosításának legbiztosabb módja a sebességi egyenlet és a kinetikus izotóphatás vizsgálata.
Az E1cB-mechanizmust leíró sebességi egyenletet viszonylag egyszerű meghatározni. Tekintsük az alábbi reakciósémát.
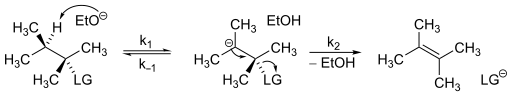
Feltételezve, hogy a mechanizmus során a karbanion koncentrációja állandó (steady-state közelítés), az E1cB-mechanizmus sebességi egyenlete:
Az egyenletből látható, hogy másodrendű kinetika adódik.[6] Az E1cB-mechanizmusok kinetikája valamelyest változhat az egyes lépések sebességének függvényében, így három alkategóriára osztható:[2]
- E1cBanion, ha a karbanion stabil és/vagy feleslegben erős bázist használnak, ami a deprotonálódást irreverzibilissé teszi, majd ezt követi a távozó csoport sebességmeghatározó kilépése (k1[base] ≫ k2).
- E1cBrev, ha az első lépés reverzibilis, de a termék képződése lassabb, mint a kiindulási anyag újraképződése, tehát ilyenkor is a második lépés a lassú (k−1[konjugált sav] ≫ k2).
- E1cBirr, amikor az első lépés lassú, de az anion kialakulása után gyors lépésben termék keletkezik (k2 ≫ k−1[konjugált sav]). Ez az eset irreverzibilis első lépést eredményez, de az E1cBanion-tól eltérően a deprotonálódás a sebességmeghatározó.
Kinetikus izotópeffektus[szerkesztés]
Deutérium[szerkesztés]
A deutériumra történő kicserélődés és a deutérium kinetikus izotópeffektus segít megkülönböztetni az E1cBrev, E1cBanion, és E1cBirr típusokat. Ha protikus, hidrogén helyett deutériumot tartalmazó oldószert használnak (pl. CH3OD), akkor a kiindulási anyagban a protonok kicserélődése nyomon követhető. Ha a visszanyert kiindulási anyag deutériumot tartalmaz, akkor a reakció nagy valószínűséggel E1cBrev mechanizmus szerint megy végbe. Ilyen esetben, mint korábban tárgyaltuk, a karbanion (akár a konjugált sav, akár az oldószer által történő) protonálódása gyorsabb, mint a távozó csoport kilépése. Ez azt jelenti, hogy a karbanion a kialakulását követően gyorsan eltávolít egy protont az oldószerről, hogy visszaalakuljon a kiindulási anyaggá.
Ha a reaktáns β-helyzetben deutériumot tartalmaz, akkor elsődleges kinetikus izotópeffektus jelzi, hogy a deprotonálódás sebességmeghatározó. A három E1cB-mechanizmus közül ez csak a E1cBirr sémával van összhangban, mivel az E1cBanion esetében az izotóp már nincs jelen, az E1cBrev mechanizmusban pedig a távozó csoport kilépése a sebességmeghatározó lépés.
Fluor-19 és szén-11[szerkesztés]
A 19F felhasználása is lehetőséget ad arra, hogy a kinetikus izotópeffektus segítségével megkülönböztessük az E1cB-mechanizmusokat. A fluor viszonylag rossz távozó csoport, gyakran alkalmazzák az E1cB-mechanizmus vizsgálatához. A fluorral végzett kinetikus izotópeffektus vizsgálatokat az orvosi kutatásokban is használják radiofarmakonok és más vegyületek nyomjelzésére. Ez a kísérlet nagyon hasznos annak eldöntéséhez, hogy a távozó csoport kilépése-e a mechanizmus sebességmeghatározó lépése, és így segít megkülönböztetni az E1cBirr és E2-mechanizmusokat. A 11C is felhasználható az átmeneti állapot szerkezeti sajátosságainak tanulmányozására. A 11C segítségével a karbanion keletkezése és annak élettartama is vizsgálható, ami nemcsak azt mutathatja meg, hogy a reakció két lépésben, E1cB-mechanizmus szerint játszódik le (ellentétben a koncertáló E2-mechanizmussal), hanem információval szolgál az átmeneti állapot élettartamával és szerkezetének stabilitásával kapcsolatban is, ami lehetővé teszi az E1cB-mechanizmus három típusának megkülönböztetését is.[7]
Aldol-reakciók[szerkesztés]
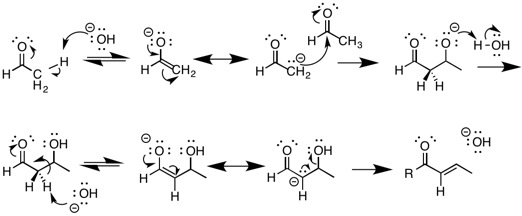
A legismertebb E1cB-eliminációs reakció a bázisos körülmények között végzett aldolkondenzáció. Ennek során egy karbonilcsoporttal rendelkező vegyület deprotonálásával enolát keletkezik. Az enolát a kiindulási anyag rendkívül stabil konjugált bázispárja, a reakció egyik köztiterméke. Az enolát nukleofilként viselkedik, így megtámadhatja egy elektrofil aldehidet. A keletkező aldol termékből protonvesztéssel egy másik enolát jön létre, melyből E1cB-mechanizmus szerinti dehidratációs reakcióban víz lép ki. A szerves kémiában az aldol-reakciók rendkívül fontosak, mivel segítségükkel szén-szén kötés alakítható ki, ami komplexebb molekulák szintézisét lehetővé teszi.[8]
Fotoindukált E1cB[szerkesztés]
Lukeman és munkatársai az E1cB fotokémiai változatáról számoltak be.[9] A cikkükben leírt fotokémiai úton indukált dekarboxilezési reakcióban karbanion intermedier keletkezik, majd ebből kilép a távozó csoport. A reakció az E1cB többi típusához képest egyedi abban, hogy a karbanion keletkezéséhez nincs szükség bázisra. A karbanion keletkezéséhez vezető lépés irreverzibilis, így a reakció E1cBirr-ként sorolandó be.

A biológiában[szerkesztés]
Az E1cB-elimináció fontos reakció a biológiában, ilyen mechanizmus szerint megy végbe például a glikolízis utolsó előtti lépése: a 2-foszfoglicerát az enoláz enzim hatására foszfoenolpiruváttá alakul át.
Hivatkozások[szerkesztés]
- ↑ Grossman, R.B.. The Art of Writing Reasonable Organic Mechanisms. New York: Springer, 53–56. o. (2008)
- ↑ a b Smith, Michael. March's advanced organic chemistry reactions, mechanisms, and structure., 6th, Hoboken, N.J.: Wiley-Interscience, 1488–1493. o. (2007)
- ↑ Ouertani, Randa (2013). „Alkaline hydrolysis of ethiofencarb: Kinetic study and mechanism degradation”. International Journal of Chemical Kinetics 45 (2), 118–124. o. DOI:10.1002/kin.20748. ISSN 0538-8066.
- ↑ Hine, Jack (1957). „The Relative Rates of Formation of Carbanions by Haloforms1”. Journal of the American Chemical Society 79 (6), 1406–1412. o. DOI:10.1021/ja01563a037. ISSN 0002-7863.
- ↑ Baciocchi, Enrico (1982. augusztus 1.). „Concerted and stepwise mechanisms in the eliminations from 1,2-dihaloacenaphthenes promoted by potassium tert-butoxide and potassium ethoxide in the corresponding alcohols”. The Journal of Organic Chemistry 47 (17), 3237–3241. o. DOI:10.1021/jo00138a007.
- ↑ McLennan, D. J. (1967). „The carbanion mechanism of olefin-forming elimination”. Quarterly Reviews, Chemical Society 21 (4), 490. o. DOI:10.1039/qr9672100490. ISSN 0009-2681.
- ↑ Matsson, Olle (2007. szeptember 1.). „Isotope effects for fluorine-18 and carbon-11 in the study of reaction mechanisms”. Journal of Labelled Compounds and Radiopharmacuticals 50, 982–988. o. DOI:10.1002/jlcr.1443.
- ↑ Wade, L.G.. Organic Chemistry. New Jersey: Prentice Hall, 1056–1066. o. (2005)
- ↑ Lukeman, Matthew (2005). „Carbanion-Mediated Photocages: Rapid and Efficient Photorelease with Aqueous Compatibility”. Journal of the American Chemical Society 127 (21), 7698–7699. o. DOI:10.1021/ja0517062. ISSN 0002-7863. PMID 15913358.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az E1cB-elimination reaction című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

![A fenti példában szereplő, etoxid bázis melletti E1cB-eliminációs mechanizmus sebességi egyenlete és kísérletileg mért sebessége {\displaystyle {\begin{aligned}{\frac {\ce {d[P]}}{{\ce {d}}t}}&={\frac {k_{1}k_{2}\mathrm {[szubsztr{\acute {a}}t][b{\acute {a}}zis]} }{k_{-1}[\mathrm {konjug{\acute {a}}lt\ sav} ]+k_{2}}}\\\mathrm {sebess{\acute {e}}g} &=k_{\mathrm {megf} }\mathrm {[szubsztr{\acute {a}}t][b{\acute {a}}zis]} \end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d7a4478fbe77c0d2765505b708f6def47df8206)