Cisz-transz izoméria


A cisz-transz izoméria, más néven geometriai izoméria vagy konfigurációs izoméria a szerves kémiában használt kifejezés, az izoméria egyik típusa. A „cisz” és „transz” előtagok latin eredetűek. A kémiában a cisz azt jelzi, hogy a funkciós csoportok a szénlánc azonos oldalán helyezkednek el,[1] míg a transz azt jelöli, hogy a funkciós csoportok a szénlánc ellentétes oldalán találhatók. A cisz-transz izomerek sztereoizomerek, azaz olyan molekulapárok, amelyeknek ugyanaz a képlete, de funkciós csoportjaik a háromdimenziós térben különböző helyzetben találhatók. Nem tévesztendő össze az E/Z izomériával, amely abszolút sztereokémiai leírás, de gyűrűs rendszerekre nem használható. A sztereoizomerekben általában kettős kötés található, mely nem fordulhat el, vagy olyan gyűrűs szerkezet található bennük, mely körül a rotáció gátolt.[2] Cisz- és transz izomerek szerves molekulákban és szervetlen koordinációs komplexekben is előfordulhatnak. A cisz vagy transz leírók az egymásba könnyen átalakuló konformációs izomerek – ilyenek például a nyílt láncú, egyszeres kötéseket tartalmazó szerkezetek – leírására nem használatosak, helyettük a „syn” és „anti” használható.
A IUPAC a „geometriai izoméria” kifejezést a „cisz-transz izoméria” elavult szinonimájának tekinti.[3]
Szerves kémia[szerkesztés]
Ha a szubsztituensek azonos irányban állnak, cisz-diasztereomerről beszélünk, míg ha a szubsztituensek ellentétes oldalra mutatnak, az a transz-diasztereomer. A rövid láncú szénhidrogének közül cisz-transz izomériát mutat például a but-2-én.
Az aliciklusos vegyületek esetén is előfordulhat cisz-transz izoméria. A gyűrűs szerkezet következtében fellépő geometriai izomériára példa az 1,2-diklórciklohexán esete:
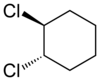 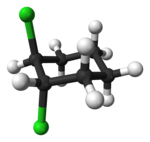
|
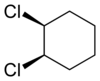 
|
| transz-1,2-diklórciklohexán | cisz-1,2-diklórciklohexán |
A fizikai tulajdonságok összehasonlítása[szerkesztés]
A cisz- és transz-izomerek gyakran eltérő fizikai tulajdonságokkal rendelkeznek. Ezek a különbségek általában a molekulák alakjának vagy dipólusmomentumának eltérő voltára vezethetőek vissza.

|

|
| cisz-2-pentén | transz-2-pentén |
|

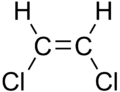
|
| cisz-1,2-diklóretén | transz-1,2-diklóretén |

|
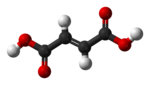
|
| cisz-buténdisav (maleinsav) |
transz-buténdisav (fumársav) |

|

|
| olajsav | elaidinsav |
Ezek a különbségek akár nagyon kicsik is lehetnek, mint a rövid, el nem ágazó láncú alkének forráspontja esetében: a pent-2-én cisz-izomerjének forráspontja például 37 °C, a transz-izomeré 36 °C.[4] A különbség nagyobb is lehet, ha a molekulában poláros kötések találhatóak, például az 1,2-diklóretén cisz-izomerje 60,1 °C-on forr, míg a transz-izomer forráspontja 48,7 °C.[5] A cisz-izomerben a két poláris C−Cl kötés dipólusmomentumának eredőjeként a molekula dipólus lesz, így a molekulák között dipól-dipól kölcsönhatás (más néven Keesom-erő) lép fel, ami a London-féle diszperziós erőhöz adódva a forráspont emelkedését eredményezi. A transz-izomer esetében nem ez a helyzet, mivel a két C−Cl kötés momentuma egymást kioltja, így a molekula eredő dipólusmomentuma nulla (ugyanakkor kvadrupólusmomentuma zérustól különböző).
A buténdisav két izomerjének annyira eltérőek a tulajdonságai és a reakciókészsége, hogy két teljesen különböző nevet adtak nekik. A cisz-izomer neve maleinsav, a transz-izomeré fumársav. A molekula polaritása kulcsfontosságú a forráspontok relatív nagyságának megállapításához, mivel az erősebb intermolekuláris kölcsönhatást eredményez, ami pedig növeli a forráspontot. A relatív olvadáspont esetében a szimmetria a döntő, mivel a szimmetrikusabb molekulák szorosabban tudnak illeszkedni a szilárd fázisban, még ha ez nem is módosítja a molekulák polaritását. Erre az összefüggésre példa az olajsav és elaidinsav: a szobahőmérsékleten folyékony olajsav a cisz-izomer, olvadáspontja 13,4 °C. A szobahőmérsékleten szilárd halmazállapotú elaidinsav a transz-izomer, ennek olvadáspontja jóval magasabb, 43 °C, ami annak köszönhető, hogy az egyenesebb transz-izomer szorosabban illeszkedő rácsot tud alkotni.
Ennek következtében a szimmetrikusabb, kevésbé poláris transz-alkének olvadáspontja magasabb, forráspontja alacsonyabb; ezzel szemben a cisz-alkének – melyek általában kevésbé szimmetrikusak és polárosabbak – alacsonyabb olvadásponttal és magasabb forrásponttal rendelkeznek.
A kettős kötés miatt kialakuló geometriai izomerek esetében – különösen azoknál, amelyekben a két szubsztituens azonos – többnyire teljesül néhány általános tendencia. Ezeket annak lehet tulajdonítani, hogy a cisz-izomer dipólusai összeadódva a molekulát dipólusossá teszik. A transz-izomer esetében a szubsztituensek dipólusai – mivel a molekula átellenes oldalán találhatóak – kioltják egymást.
Általános tendenciaként elmondható, hogy a transz-alkének olvadáspontja magasabb, inert oldószerben való oldhatóságuk pedig kisebb mértékű, mivel a transz-alkének a cisz-alkéneknél általában szimmetrikusabbak.[6]
A transz-alkénekben NMR-spektroszkópiával mért vicinális csatolási állandók (3JHH) nagyobbak (12–18 Hz között; jellemzően 15 Hz), mint a cisz-izomerekben (0–12 Hz között; jellemzően 8 Hz).[7]
Stabilitás[szerkesztés]
Aciklusos rendszerek esetén rendszerint a transz-izomer a stabilabb. Ennek jellemzően az az oka, hogy a cisz-izomerben a szubsztituensek sztérikusan zsúfoltabban helyezkednek el. Ennek megfelelően a transz-izomerek égése kevésbé exoterm, ami nagyobb termokémiai stabilitásra utal. A Benson-féle képződéshő csoportadditivitási adatokban a cisz-izomerek 1,1 kcal/mol értékkel instabilabbak. Léteznek kivételek ez alól a szabály alól, például az 1,2-difluoretilén, az 1,2-difluordiazén (FN=NF), és több más, halogénnel és oxigénnel szubsztituált etilénszármazék. Ezekben az esetekben a cisz-izomer stabilabb a transz-izomernél.[8] Ezt a jelenséget cisz-hatásnak nevezik.[9]
E/Z jelölés[szerkesztés]

Az alkén izomerek elnevezésére a cisz-transz rendszert általában csak akkor lenne szabad használni, ha a kettős kötéses szénatomokhoz csak kétféle szubsztituens kapcsolódik, ilyenkor egyértelmű, hogy mely szubsztituensek egymáshoz képesti helyzetéről van szó. Bonyolultabb esetekben a cisz-transz jelölés általában a leghosszabb szénláncra vonatkozik, melyet a molekula nevében az alaplánc jelöl. A IUPAC E/Z jelölés minden esetben egyértelmű, így különösen hasznos háromszorosan vagy négyszeresen helyettesített alkének elnevezéséhez.
A Z (a német zusammen szóból) jelentése „együtt”, az E (a német entgegen szóból) pedig „szemben”. Vagyis a Z-izomerben a magasabb prioritású csoportok vannak egymáshoz képest cisz-helyzetben, míg az E-izomerben a magasabb prioritású csoportok transz-állásúak. Azt, hogy egy molekula konfigurációja E vagy Z, azt a Cahn–Ingold–Prelog prioritási szabályok döntik el; a nagyobb rendszámú atomok magasabb prioritásúak. Meg kell határozni a kettős kötést hordozó két szénatom szubsztituenseinek prioritását. Ha a két, magasabb prioritású szubsztituens azonos oldalon található, akkor Z, ellenkező esetben E elrendeződésről van szó.
Mivel a cisz-transz és az E/Z rendszer az alkénhez kapcsolódó különböző csoportokat hasonlít össze, ezért nem feltétlenül igaz, hogy a Z felel meg a cisz, az E pedig a transz-izomernek. Például a transz-2-klórbut-2-én (a két – C1 és C4 – metilcsoport transz helyzetű a but-2-én vázon) nem más, mint a (Z)-2-klórbut-2-én (a klór és C4 azonos oldalon vannak, mivel C1 és C4 átellenes helyzetű).
Szervetlen kémia[szerkesztés]
Cisz-transz izoméria a szervetlen vegyületekben is felléphet, ezek közül a legismertebbek a diazének és a koordinációs vegyületek.
Diazének[szerkesztés]
A diazének (és a rokon difoszfének) is mutathatnak cisz-transz izomériát. A szerves vegyületekhez hasonlóan itt is általában a cisz-izomer a reakcióképesebb, csak ez az izomer képes az alkéneket és alkineket alkánná redukálni, bár ennek más oka van: a transz-izomer hidrogénjei nem tudnak az alkén redukciójához megfelelő helyzetbe kerülni, de a cisz-izomer – eltérő téralkata miatt – képes erre.
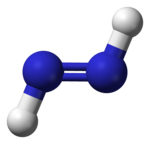 
|
 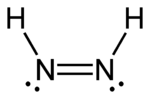
|
| transz-diazén | cisz-diazén |
Koordinációs komplexek[szerkesztés]
Oktaéderes vagy síknégyzetes szervetlen koordinációs komplexek esetén is léteznek cisz-izomerek, amelyekben a hasonló ligandumok egymáshoz közelebb vannak, és vannak transz-izomerek, melyekben a ligandumok távolabb helyezkednek el egymástól.
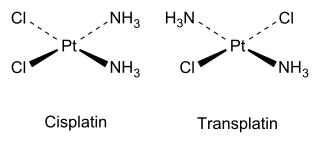
Például a síknégyzetes Pt(NH3)2Cl2 komplexnek két izomerje létezik, amint azt Alfred Werner 1893-ban megmutatta. A cisz-izomer – teljes néven cisz-diammin-dikloroplatina(II) – tumorellenes hatását Barnett Rosenberg fedezte fel 1969-ben, ma ezt a ciszplatin nevű vegyületet kemoterápiás szerként alkalmazzák. A transz-izomer (transzplatin) ugyanakkor nem rendelkezik számottevő rákellenes hatással. Mindkét izomer előállítható szintetikus úton, a keletkező izomer a transz-hatás segítségével szabályozható.
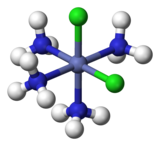
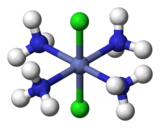
Az MX4Y2 összetételű oktaéderes komplexeknek is két izomerje létezik (M itt fématomot jelöl, X és Y pedig két különböző típusú ligandumot). A cisz-izomerben a két Y ligandum egymással szomszédos helyzetben található, és egymással 90°-os szöget zárnak be, ilyen a bal oldali ábrán a két zölddel jelölt klóratom a cisz-[Co(NH3)4Cl2]+ komplexben. A jobb oldali ábrán látható transz-izomerben a két Cl a központi Co atom átellenes oldalán helyezkedik el.
Az MX3Y3 oktaéderes komplexek hasonló típusú izomériája a faciális-meridionális (vagy fac-mer) izoméria. Ha a három azonos ligandum egy oktaéderlap három csúcsát foglalja el, az a fac-izomer, míg a mer-izomerben a fématom és a három azonos ligandum egy síkban helyezkedik el.[10] A fém-karbonil vegyületek fac- vagy mer-izomerjeit infravörös spektroszkópiával lehet meghatározni.
Hivatkozások[szerkesztés]
- ↑ Charlton T. Lewis, Charles Short, A Latin Dictionary (Clarendon Press, 1879) Entry for cis
- ↑ Reusch, William: Stereoisomers Part I. Michigan State University, 2010 (Hozzáférés: 2015. április 7.)
- ↑ geometric isomerism, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ Chemicalland values. Chemicalland21.com. (Hozzáférés: 2010. június 22.)
- ↑ CRC Handbook of Chemistry and Physics, 85th, 3-170. o. (2005. április 25.)
- ↑ March, Jerry. Advanced Organic Chemistry, Reactions, Mechanisms and structure, 3rd, 111. o.. ISBN 0-471-85472-7
- ↑ Williams, Dudley H.. Table 3.27, Spectroscopic Methods in Organic Chemistry, 4th rev., McGraw-Hill (1989. április 25.). ISBN 007707212X
- ↑ Bingham, Richard C. (1976. április 25.). „The stereochemical consequences of electron delocalization in extended π systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena”. J. Am. Chem. Soc. 98 (2), 535–540. o. DOI:10.1021/ja00418a036.
- ↑ Bingham, Richard C. (1976. április 25.). „Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane”. J. Am. Chem. Soc. 119 (20), 4789. o. DOI:10.1021/ja963819e.
- ↑ A Dictionary of Chemistry. sixth. (hely nélkül): Oxfird University Press. 2008. 297. o. ISBN 978-0-19-920463-2
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Cis–trans_isomerism című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.