Tioészter
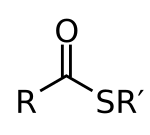
A tioészterek C−S−CO−C funkciós csoportot tartalmazó vegyületek, a karbonsavak és tiolok közötti észterképzési reakció termékei. A tioészterek széles körben előfordulnak a biokémiában, a legismertebb ilyen származék az acetil-koenzim-A.
Szintézisük[szerkesztés]
Számos módszerrel előállíthatók,[1] de a fő eljárás tiolok és karbonsavak vízelvonószer jelenlétében végzett kondenzációs reakciója:[2]
- RSH + R'CO2H → RSC(O)R' + H2O
Gyakran használt vízmegkötő az N,N'-diciklohexilkarbodiimid (DCC) vagy hozzá hasonló reagensek.[3] Savanhidridek és egyes laktonok is reakcióba lépnek tiolokkal, bázis jelenlétében.
Alkoholokból kényelmesen előállíthatók tioecetsav felhasználásával (Mitsunobu-reakció).[4]
Ugyancsak tioésztert szolgáltat az alkinek és alkének tiolok jelenlétében végzett karbonilezése.[5]
Reakcióik[szerkesztés]
A tioészterek karbonil szénatomja nukleofilekkel szemben reakcióképes, a reakciókészség a savkloridokéra emlékeztet, de enyhébb azokénál. A tioészterek így aminokkal amidokat adnak:
 Thioesters provide useful chemoselectivity in the synthesis of biomolecules.[6]
Thioesters provide useful chemoselectivity in the synthesis of biomolecules.[6]
A tioészterek egyedülálló reakciója a Fukuyama-kapcsolás, melynek során a tioészter palládium katalizátor hatására cinkorganikus halogeniddel kapcsolódva ketonná alakul.
A tioészterek karbonilcsoportjával szomszédos C−H kötés enyhén savas (erősebben, mint az észterekben[7][8]) és aldolkondenzációs reakcióra képes. Ilyen reakció játszódik le a zsírsavak bioszintézise során.
Biokémia[szerkesztés]

A tioészterek számos bioszintetikus reakcióban intermedierek, többek között a zsírsavak és a mevalonát, a szteroidok előanyagának képződésében és lebontásában is előfordulnak. Ilyen vegyületek például a malonil-CoA, acetoacetil-CoA, propionil-CoA és a cinnamoil-CoA. Az acetogenezis során acetil-CoA képződik. A szárazföldi biomassza jelentős részét adó lignin bioszintézise a kávésav tioészter származékán át megy végbe.[9]
Ezek a vegyületek a szintetikusan előállított megfelelőikkel analóg módon keletkeznek azzal a különbséggel, hogy esetükben a vízelvonószer az ATP. Ezen kívül a tioészterek fontos szerepet játszanak a fehérjék ubikvitinnel történő megjelölésében, ami a lebontandó fehérjék jelzésére szolgál.
Tioészterek és az élet eredete[szerkesztés]
A tioészterek az élet lehetséges előfutárai.[10] Duve szerint:
- Árulkodó jel, hogy a tioészterek nélkülözhetetlen köztitermékek számos olyan kulcsfontosságú folyamatban, melyben ATP keletkezik vagy használódik fel. A tioészterek részt vesznek az összes észter, köztük a bonyolult lipidekben találhatóak szintézisében is. Előfordulnak számos sejtkomponens, például fehérjék, zsírsavak, szterinek, terpének, porfirinek és más vegyületek szintézisében is. Ráadásul a tioészterek több, különösen ősi, ATP-t felépítő folyamatban kulcsfontosságú köztitermékek. Mindezen esetekben a tioészter közelebb van az energiát felszabadító vagy felhasználó folyamathoz, mint az ATP. Más szavakkal a tioészterek akár be is tölthették volna az ATP szerepét egy eredetileg ATP-től mentes „tioészter világban”. Végső soron [ezek] a tioészterek nyithatták meg az utat az ATP előtt, annak foszfátcsoportok közötti kötést kialakító képessége révén.
Izomer vegyületek: tionészterek[szerkesztés]

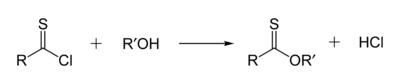
A tionészterek a tioészterek izomerjei. A tionészterekben a kénatom az észter karbonil oxigénjét helyettesíti. A metil-tionbenzoát képlete C6H5C(S)OCH3. Ezeket a vegyületeket jellemzően tioacil-klorid és alkohol reakciójával állítják elő, de észterekből is előállíthatók Lawesson-reagenssel.[11]
Jegyzetek[szerkesztés]
- ↑ Fujiwara, S.; Kambe, N.. Thio-, Seleno-, and Telluro-Carboxylic Acid Esters, Topics in Current Chemistry. Berlin / Heidelberg: Springer, 87–140. o.. DOI: 10.1007/b101007 (2005). ISBN 978-3-540-23012-0
- ↑ Synthesis of thioesters. Organic Chemistry Portal
- ↑ Mori, Y.; Seki, M. (2007). „Synthesis of Multifunctionalized Ketones Through the Fukuyama Coupling Reaction Catalyzed by Pearlman's Catalyst: Preparation of Ethyl 6-oxotridecanoate”. Org. Synth. 84, 285. o. ; Coll. Vol. 11: 281
- ↑ Volante, R. (1981). „A new, highly efficient method for the conversion of alcohols to thiolesters and thiols”. Tetrahedron Letters 22 (33), 3119–3122. o. DOI:10.1016/S0040-4039(01)81842-6.
- ↑ Ullmann Vegyipari Enciklopédia
- ↑ (2011) „Chemoselectivity in chemical biology: Acyl transfer reactions with sulfur and selenium”. Acc. Chem. Res. 44, 752–761. o. DOI:10.1021/ar200081s. PMID 21639109.
- ↑ (2013) „Malonic Acid Half Oxyesters and Thioesters: Solvent-Free Synthesis and DFT Analysis of Their Enols”. Org. Lett. 15, 3805–3807. o. DOI:10.1021/ol400804b.
- ↑ (1991) „Heterocyclic Aromatic Anions with 4n + 2 pi-Electrons”. J. Org. Chem. 56, 4218–4223. o. DOI:10.1021/jo00013a027.
- ↑ Lehninger, A. L.; Nelson, D. L.; Cox, M. M.. Principles of Biochemistry, 3rd, New York: Worth Publishing (2000). ISBN 1-57259-153-6
- ↑ de Duve, C. (1995). „The Beginnings of Life on Earth”. American Scientist 83 (5), 428–437. o. [2017. június 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. augusztus 25.)
- ↑ Cremlyn, R. J.. An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons (1996). ISBN 0-471-95512-4
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Thioester című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.


