„Kromofor” változatai közötti eltérés
| [ellenőrzött változat] | [ellenőrzött változat] |
a r2.7.1) (Bot: következő hozzáadása: ca:Cromòfor |
a Kémia kategória eltávolítva; Spektroszkópia kategória hozzáadva (a HotCattel) |
||
| 70. sor: | 70. sor: | ||
[[Kategória:Színek]] |
[[Kategória:Színek]] |
||
[[Kategória: |
[[Kategória:Spektroszkópia]] |
||
[[en:Chromophore]] |
[[en:Chromophore]] |
||
A lap 2012. július 18., 18:23-kori változata
A kromofor a molekula azon része, mely felelős a színéért.[1] A szín úgy keletkezik, hogy a molekula abszorbeál egy bizonyos hullámhosszúságú látható fényt és kibocsát egy másik vagy azonos hullámhosszúságú látható fényt.
A kromofor a molekula egy tartománya, ahol két molekulapálya energiakülönbsége a látható spektrum tartományába esik. A látható fény, amely a kromoforra esik, abszorbeálódik, gerjesztve ezzel egy elektront az alapállapotából a gerjesztett állapotba.
A biológiában a fényenergia felfogására vagy érzékelésére szolgáló molekulákban a kromofor az a funkciós csoport, amely a molekula téralkatát megváltoztatja, ha azt fény éri.
Kromofortípusok

A kromofor legtöbbször a következő két csoport valamelyikébe sorolható: konjugált pi rendszer (rezonáló rendszer néven is ismert) vagy metál komplex forma.
Konjugált pi rendszerű kromofor
A konjugált kromofornál, az elektronok energia szintek között ugrálnak, melyek ki vannak terjesztve pi pályákkal, amelyeket váltakozó egyedi és dupla kötések sorozata hoz létre, gyakorta aromatikus rendszerekben.
Ismert példák a retina (a szemben a fény érzékelés eszköze), különböző élelmiszerfestékek, pH indikátorok, béta-karotin, antociánok. A kromofor szerkezeteknél több tényező határozza meg, hogy a spektrum mely tartományait fogja abszorbeálni. Amikor egy konjugált rendszer az egyre kevésbé telített kötések felé terjed, akkor a molekula az egyre hosszabb hullámhosszúságú sugárzásokat fogja elnyelni. A Woodward-Fieser szabály használható a maximális abszorpciós hullámhossz kiszámítására.

Metál komplex kromofor
A metál komplex kromofor úgy keletkezik, hogy az atomi pályák széthasadnak mialatt az átmenetifémek ligandummá kötödnek. Erre példa a klorofill, a hemoglobin,a hemocianin és s a színes ásványok, mint a malachit ás a ametiszt. A kromoforok négy pirrol gyűrűből állnak. Két típusuk létezik:
- A pirrolok egy nyílt láncot alkotnak, és nincs fém: ilyenek a phytocrome, a phycobilin és a bilirubin.
- A pirrolok egy gyűrűt (porfirin) alkotnak, fémmel a központjukban: ilyenek a hem, és a klorofill.
Auxokrom
Az auxokrom egy funkcionális csoport, mely a kromoforhoz kapcsolódik és módosítja a kromofor abszorpciós képességét, megváltoztatva az abszorpciós hullámhosszt.
Halokromizmus a kromoforokban
Halokromizmus-ról beszélünk, amikor az anyag megváltoztatja a színét a pH érték változásával együtt. Ez a pH indikátorok tulajdonsága, melyek molekuláris szerkezete megváltozik a pH változásákor.Ez a változás kihatással van a kromoforra. Például, a fenolftalein egy pH indikátor, mely szerkezete változik, ahogy a pH változik a környezetében, a táblázat szerint:
| pH érték | Kondíció | Szín |
|---|---|---|
| 0 – 8.2 | savas vagy közel semleges | nincs szín |
| 8.2 - 12 | bázikus | pink - fukszia |
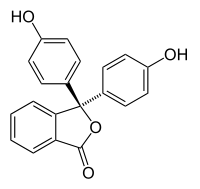
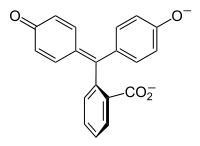
A 0 – 8 pH tartományban, a molekula három aromatikus gyűrűje mind kötődik egy hibridizált szénatomhoz. Ez az aromatikus gyűrű csak az ultraibolya tartományba seő sugárzást képes abszorbeálni, így az anyag színtelennek látszik s 0 – 8 pH tartományban.
Amikor a pH érték 8.2 főlé emelkedik, a központi szén része lesz egy dupla kötésnek , és sp² hibridizáltá válik és elhagyja a p pályát átlapolva a gyűrű pi kötését. Ettől a három gyűrű egyesül és egy kiterjedt kromofort alkot, amely hosszabb hullámhosszúságú látható fényt képes abszorbeálni és ettől fukszia színűnek látszik.[2] 0 – 12 pH tartományban, más molekula szerkezetek más színeket eredményeznek. Ilyen eset például a fenolftalein
Külső hivatkozások
- A General Overview on Visual Perception (angolul)
- http://tolweb.org/accessory/Cephalopod_Chromatophore?acc_id=2038
- http://www.edinphoto.org.uk/1_P/1_photographers_maxwell.htm
- http://www.yourdictionary.com/photophore
- szin.lap.hu/
- http://www.webexhibits.org/causesofcolor/0.html
