Keláthatás

A kelátképződés a komplexképződés speciális esete. A komplexképződés fogalma Alfred Werner, svájci kémikus munkájának eredménye: ő ismerte fel 1893-ban a [Co(NH3)4Cl2]Cl molekula helyes, oktaéderes szerkezetét, ami a kémiai kötés akkori fogalmával nem volt magyarázható. Felismerését 1913-ban kémiai Nobel-díjjal jutalmazták.
Keláthatás[szerkesztés]
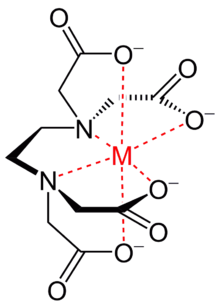
A kelátok fogalmát mintegy húsz évvel a komplexvegyületek felfedezése után határozták meg. A kelátligandumok olyan, több donoratomú, multidentát (többfogú, vagyis több kötéssel kapcsolódó) ligandumok, amelyek heterociklust alkotva két vagy több kötést alakítanak ki ugyanazon központi atommal. Az ilyen heterociklust nevezik kelátgyűrűnek, a heterociklust generáló iont pedig kelátképző reagensnek. A kelátkomplexek lehetnek anionos, kationos vagy semleges molekulák. A kelátkomplexek kialakulását és a kelátkomplexek stabilitását kvalitatívan figyelve arra a következtetésre jutottak, hogy a kelátligandumok stabilabb komplexeket hoznak létre, mint a monodentát (egyfogú, vagyis egy kötéssel kapcsolódó) ligandumok. A kelátkomplex stabilitását a központi atomot is tartalmazó heterociklus növeli. A stabilitás növekedését Schwarzenbach javaslatára keláthatásnak (más néven keláteffektus) nevezik. Jorge a fémes kelátok extra stabilitását az entrópiahatásnak tulajdonítja.
Arra következtetett, hogy a három molekula az első reakcióig önállóan mozog, de a reakció után együtt kell mozogniuk. A három molekula transzlációs mozgását egyetlen molekula transzlációs mozgása helyettesíti, tehát két ligandum transzlációs entalpiája elvész. A kelátot létrehozó reakció előtt csak két független transzlációs mozgás van, így a reakcióval csak egy molekula veszíti el a transzlációs szabadságnak megfelelő entrópiáját (ez a magyarázat nagyon egyszerű, mert csak a transzlációs szabadságra utal).
Különböző termodinamikai adatok arra utalnak, hogy különböző fémionok kelátkomplexeinek kialakulása közben a keláteffektus mértéke függ a fémionok természetétől. Bjerrum és Nielsen adatai szerint az átmenetifémek ionjainak keláthatása nagyobb, mint a főcsoportokba tartozó fémionoké.
Spike és Parry adatai arra utalnak, hogy a nem átmenetifémek – mint például a cink és a kadmium – komplexeinél a keletkezési entalpia variációja elhanyagolható, ami azt jelenti, hogy a keláteffektus valójában az entrópiahatás. Átmenetifémek – mint például a réz(II) – komplexeiben a keláthatás részben az entalpia hatása lehet.
A keláthatás annál nagyobb, minél több, megfelelő méretű gyűrű képződik. A legkedvezőbb az öt atomból álló gyűrű, az ennél nagyobb gyűrűk stabilitása csökken. A semleges kelátkomplexek vízben gyakran kevéssé oldódnak, emiatt a komplex egyensúlyok vizsgálata nehezebb. A kelátképzés ideális lehetőség fémionok megkötésére, így gyakorlati szempontból ezek a reakciók nagy jelentőséggel bírnak.
Források[szerkesztés]
| Ez a szócikk nem tünteti fel a független forrásokat, amelyeket felhasználtak a készítése során. Emiatt nem tudjuk közvetlenül ellenőrizni, hogy a szócikkben szereplő állítások helytállóak-e. Segíts megbízható forrásokat találni az állításokhoz! Lásd még: A Wikipédia nem az első közlés helye. |
