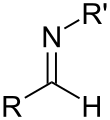
Imin

Az imin olyan szerves kémiai funkciós csoport, amelyben szén–nitrogén kettős kötés található, és a nitrogénatomhoz hidrogén (H) vagy szerves csoport kapcsolódik. Ha ez a csoport nem hidrogénatom, akkor a vegyület Schiff-bázis.[1] A szénatom további két egyszeres kötéssel rendelkezik.[2][3][4]
Az iminek nevezéktana és csoportosítása[szerkesztés]
Az iminek a karbonilvegyületekhez hasonlítanak, a karbonil oxigént NR csoport helyettesíti. Ha R3 = H, a vegyület primer imin, ha R szénhidrogéncsoport, szekunder iminről beszélünk. Az iminek változatos reakcióik révén a kémia számos területén előfordulnak.[4] Ha az R3 csoport OH, akkor a vegyületet oximnak, míg ha R3 NH2, akkor hidrazonnak nevezzük.
Aldiminek és ketiminek[szerkesztés]
Az olyan primer iminek, amelyekben a C szénhidrogéncsoporthoz és H-hez kapcsolódik, primer aldiminek, az ugyanilyen csoportokat tartalmazó szekunder iminek szekunder aldiminek.[5]
Az olyan primer iminek, amelyekben a C két szénhidrogéncsoporthoz kapcsolódik, primer ketiminek; az ugyanilyen csoportokat tartalmazó szekunder iminek a szekunder ketiminek.[6]
-
Primer aldimin
-
Szekunder aldimin
-
Primer ketimin
-
Szekunder ketimin
Iminek szintézise[szerkesztés]
Imineket jellemzően primer aminok és aldehidek vagy ritkábban ketonok kondenzációs reakciójával állítanak elő. Mechanizmusát tekintve ez a reakció nukleofil addíció révén keletkező −C(OH)(NHR)− félaminál köztiterméken keresztül halad, melyből vízkilépéssel imin keletkezik. Ennek a reakciónak az egyensúlya rendszerint a karbonilvegyület és az amin irányába van eltolva, ezért ahhoz, hogy a reakció az iminképződés irányában menjen végbe, azeotróp desztilláció vagy valamilyen vízelvonó anyag, például molekulaszűrő alkalmazása szükséges.
Az iminek szintézisére számos egyéb módszer ismert.
- C–H savak és nitrozovegyületek kondenzációs reakciója.
- N-halogénezett tritil-aminok Stieglitz-átrendeződése.
- Félaminálok dehidratálása.[7]
- Alkének és hidrogén-azid közötti Schmidt-reakcióval.
- Arénból kiindulva Hoesch-reakcióval nitril és sósav hatására.
- 3-tiazolinok Asinger-reakcióval végzett többkomponensű szintézise.
Iminek reakciói[szerkesztés]
Az iminek legfontosabb reakciója vízzel történő hidrolízisük, melynek során a megfelelő amin és karbonilvegyület keletkezik. Ezen kívül az imin funkciós csoport számos reakcióban részt vesz, ezek közül sok az aldehidek és ketonok reakcióival analóg.
- Az iminek aminokkal aminál képződése közben reagálnak.
- Az iminek diénekkel az aza-Diels-Alder reakcióban tetrahidropiridin képződése közben reagálnak.
- Az iminek meta-klórperbenzoesavval (mCPBA) oxaziridinné oxidálhatók.
- A Povarov-reakcióban az aromás iminek enoléterekkel kinolin képződése közben reagálnak.
- A toziliminekből α,β-telítetlen karbonilvegyületekkel allil-amin keletkezik az aza-Baylis–Hillman-reakcióban.
- Az aminok Eschweiler–Clarke-reakció során hangyasavval történő alkilezésének köztitermékei iminek.
- Az egyik szénhidrátkémiai reakció, az Amadori-átrendeződés iminen keresztül megy végbe.
- Stabilizálatlan szulfónium-ilid által történő metilén-transzfer reakcióval az iminekből aziridin gyűrű jöhet létre.
- Az iminek a reduktív aminálás köztitermékei.
Sav-bázis reakciók[szerkesztés]
A kiindulási aminokhoz némileg hasonlóan az iminek enyhén bázikusak és reverzibilisen protonálódva imíniumsókat alkotnak. Az imínium származékok különösen érzékenyek az aminná történő redukcióra transzfer hidrogénezés vagy nátrium-cianoborohidrid sztöchiometrikus mennyiségének hatására. Mivel az aszimmetrikus ketonokból származó iminek prokirálisak, redukciójuk felhasználható királis aminok szintézisére.
Ligandumként[szerkesztés]
Az iminek a komplexkémiában gyakori ligandumok. A szalicilaldehid és acetil-aceton kondenzációjával imintartalmú kelátképzők családjait állítják elő, ezek közé tartozik például a szalén.
Iminek redukciója[szerkesztés]
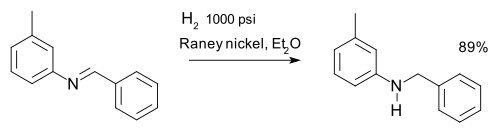
Az iminek hidrogénezéssel aminná redukálhatók, erre példa az m-tolilbenzilamin szintézise:[8]
Egyéb alkalmazható redukálószerek a lítium-alumínium-hidrid és a nátrium-borohidrid.[9]
Az első aszimmetriás imin redukciót 1973-ban hajtotta végre Henri B. Kagan: Ph(Me)C=NBn-t hidroszililezett PhSiH2 felhasználásával DIOP királis ligandum és (RhCl(CH2CH2)2)2 katalizátor mellett.[10] Azóta számos más rendszert is tanulmányoztak.[11][12]
Biológiai szerep[szerkesztés]
Az iminek a természetben sok helyen megtalálhatók. A B6-vitamin például elősegíti az aminosavak iminképződéssel történő deaminálását.
Kapcsolódó szócikkek[szerkesztés]
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az Imine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások[szerkesztés]
- ↑ Schiff base, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ imines, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ March Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- ↑ a b Fletcher, Dermer, Fox, Nomenclature of Organic Compounds (1974) doi:10.1021/ba-1974-0126.ch023
- ↑ aldimines, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ ketimines, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ W. J. Middleton and H. D. Carlson (1988). „Hexafluoroacetone imine”. Org. Synth.. ; Coll. Vol. 6: 664.
- ↑ C. F. H. Allen and James VanAllan (1955). „m-Tolylbenzylamine”. Org. Synth., 827. o. ; Coll. Vol. 3
- ↑ For example: Ieva R. Politzer and A. I. Meyers (1988). „Aldehydes from 2-Benzyl-4,4,6-trimethyl-5,6-dihydro-1,3(4H)-oxazine: 1-Phenylcyclopentanecarboxaldehyde”. Org. Synth.. ; Coll. Vol. 6: 905
- ↑ (1973) „Synthese asymetrique d'amines par hydrosilylation d'imines catalysee par un complexe chiral du rhodium”. Tet. Lett. 14 (49), 4865. o. DOI:10.1016/S0040-4039(01)87358-5.
- ↑ (1999) „Catalytic Enantioselective Addition to Imines”. Chem. Rev. 99 (5), 1069. o. DOI:10.1021/cr980414z. .
- ↑ J. Martens: Reduction of Imino Groups (C=N) in (G. Helmchen, R. W. Hoffmann, J. Mulzer, E. Schaumann) Houben-Weyl Stereoselective Synthesis, Workbench Edition E21 Volume 7, S. 4199-4238, Thieme Verlag Stuttgart, 1996, ISBN 3-13-106124-3.