„Moezin” változatai közötti eltérés
| [ellenőrzött változat] | [ellenőrzött változat] |
| 32. sor: | 32. sor: | ||
===uPAR-szabályzás=== |
===uPAR-szabályzás=== |
||
A moezin és a [[merlin (fehérje)|merlin]] szabályozzák az urokinázreceptor-dependens endotélsejt-vándorlást, -adhéziót és angiogenezist. Feltehetően a moezinen keresztül aktiválja az uPAR az integrineket.<ref name="Degryse 2017">{{cite journal|author=Degryse B, Britto M, Shan CX, Wallace RG, Rochfort KD, Cummins PM, Meade G, Murphy RP|title=Moesin and merlin regulate urokinase receptor-dependent endothelial cell migration, adhesion and angiogenesis|journal=Int J Biochem Cell Biol|year=2017|month=július|volume=88|pp=14–22|doi= 10.1016/j.biocel.2017.04.012|pmid=28473293|accessdate=2023-12-17}}</ref> A merlin ezeket gátolja, ugyanis expressziója csökkentése növeli a fibroonektin- és vibronektinkötő integrinek szabályzása révén a sejtek vándorlását és adhézióját.<ref name="Degryse 2017"/> |
A moezin és a [[merlin (fehérje)|merlin]] szabályozzák az urokinázreceptor-dependens endotélsejt-vándorlást, -adhéziót és angiogenezist. Feltehetően a moezinen keresztül aktiválja az uPAR az integrineket.<ref name="Degryse 2017">{{cite journal|author=Degryse B, Britto M, Shan CX, Wallace RG, Rochfort KD, Cummins PM, Meade G, Murphy RP|title=Moesin and merlin regulate urokinase receptor-dependent endothelial cell migration, adhesion and angiogenesis|journal=Int J Biochem Cell Biol|year=2017|month=július|volume=88|pp=14–22|doi= 10.1016/j.biocel.2017.04.012|pmid=28473293|accessdate=2023-12-17}}</ref> A merlin ezeket gátolja, ugyanis expressziója csökkentése növeli a fibroonektin- és vibronektinkötő integrinek szabályzása révén a sejtek vándorlását és adhézióját.<ref name="Degryse 2017"/> |
||
===Ras-szabályzás=== |
|||
A moezin részt vesz a [[Son of sevenless|SOS]] aktivitásának irányításában, mely fontos a normál Ras-funkcióban és bizonyos ráktípusokban a Ras-diszfunkció oka.<ref name="Sperka 2011">{{cite journal|author=Sperka T, Geißler KJ, Merkel U, Scholl I, Rubio I, Herrlich P, Morrison HL|editor=Skoulakis EMC|title=Activation of Ras Requires the ERM-Dependent Link of Actin to the Plasma Membrane|journal=PLoS ONE|volume=6|issue=11|page=e27511|date=2011-11-21|accessdate=2023-12-18|pmid =22132106|pmc=3221661|doi=10.1371/journal.pone.0027511}}</ref> |
|||
==Klinikai jelentősége== |
==Klinikai jelentősége== |
||
A lap 2023. december 18., 16:42-kori változata
| Moezin | |
 | |
| Azonosítók | |
| Jel | MSN |
| Entrez | 4478 |
| RefSeq | NM_002444 |
| UniProt | P26038 |
| Egyéb adatok | |
| Lokusz | X krom. q12 |
A moezin az MSN gén által kódolt fehérje.[1][2]
A moezin (membránszervező kiterjesztő tüskefehérje) az ERM fehérjecsalád tagja az ezrinhez és a radixinhoz hasonlóan. Ezek a sejtmembránok és az aktinalapú sejtvázak összekötői.[3]
A moezin filopódiumokban és a sejtfelismerésben, -kommunikációban és -mozgásban fontos más membrános kiemelkedésekben található.[3] Leukociták uropódiumában is megtalálható.[4]
Szerkezete
Az ERM család tagjai a merlinnel és a talinnal 85% N-terminális hasonlóságot mutatnak, és mindegyik a 4.1 sáv szupercsaládba tartozik.[5]
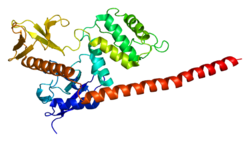
A moezin 3 doménből áll: egy 297 aminosavas N-terminális FERM doménből, egy 169 aminosavas központi α-doménből heptád hidrofobicitásmintával és csavart hélixszel, valamint egy 111 aminosavas C-terminális farokból, mely a FERM domént takarja.[6] A farok és a FERM domén közti kötés felbontásával a Thr558 foszforilációja a fehérjét aktiválja.[6]
A FERM domén részei az F1, az F2 és az F3 szerkezeti modulok, ezek együtt lóhere alakú szerkezetet alkotnak. Az F1 (4–82. aminosav) ötszálú vegyes β-redőből áll egy α-hélixszel szemben, mely után rövid 310-hélix található a 3. szál kezdete előtt. Az F2 (96–195. aminosav) öt α-hélixből áll, a B és C hélixek közt egy hosszú körből és rövid α-hélixből álló 36 aminosavas kitérővel. Az F3 (204–297. aminosav) két merőleges antipárhuzamos β-redőből és a két redőt összekötő körben egy 310-hélixből áll. A lóhere közepét nagyrészt az F1 és F2 közti 13 és az F2 és F3 közti 8 aminosavas összekötés tölti ki.[6] Ezek szerkezete hasonlít egy nem a FERM doménekhez hasonló szekvenciájú fehérjékhez: az F1 az ubikvitinhez, az F2 az acil-CoA-kötő proteinhez, az F3 pedig többek közt a foszfotirozin-kötő, a pleksztrinhomológia- és az Enabled/VASP homológia 1 (EVH1) doménekhez hasonlít.[6]
Funkciója
A moezin fontos a lipopoliszacharidok stimulálta sejtkommunikációban és gyulladásban, valamint a makrofágok lipopoliszacharidra adott válaszában.[7] Homozigóta MSN-knockout egerekben szubkután LPS-injekció után harmadakkora a gyulladás mértéke.[5]
Sejtadhézió
A moezin fontos a sejtmembrán és az aktinalapú sejtváz összekapcsolásához, hasonlóan az ezrinhez és a radixinhez. E fehérjék a sejtalak változásaival összekapcsolt eseményekben is részt vesznek, ilyenek például a sejtadhézió és -kommunikáció.[5] Ezt a foszfatidilinozitol-4,5-biszfoszfát (PIP2) autoinhibíciós Lys253/254- és Lys262/263-kötése teszi lehetővé.[8] A dinamikusan szabályzott ERM-aktiváció olyan folyamatokhoz szükséges, mint például a mitózis, a vérlemezke-aktiváció és (Drosophila esetén) a szárnylemezfejlődés.[8] A PIP2 az ERM-proteinek konformációs aktivációját befolyásolja, mely lehetővé teszi kapcsolódásukat a CD44-hez.[8] Továbbá egy C-terminális treonin foszforilációja is hozzájárul az aktivációhoz, ez azonban az aktív állapotot stabilizálja.[8]
A TMIGD1 sejtadhéziós fehérje is kötődik a moezinhez, és szabályozza a tubulinacetilációt, sejtadhéziót és -vándorlást.[9]
Bőröregedés
A moezin egy 2010-es kutatás szerint fontos a bőröregedés lassításában, ugyanis expressziójának csökkenése gyorsítja a humán bőrmikroerek endotél sejtjeinek (HDMEC) öregedését.[10] Ezenkívül a moezin expressziójának csökkenése lassítja a sejtproliferációt is.[10]
Klatrinburkolt vezikulumok szállítása
A moezin szabályozza a klatrinburkolt vezikulumok szállítását.[11] Fluoreszcenciamikroszkópiás tanulmányok alapján a moezin-siRNS erősíti a klatrinburkolt vezikulumok laterális mozgását és abnormális csoportosulását, és az N-moezint túlexpresszáló sejtekben is összeállnak a klatrinburkolt vezikulumok. A teljes foszfatidilinozit-4,5-biszfoszfát-kötő doménnel rendelkező moezin áll csak a klatrinburkolt vezikulumokkal össze.[11] Így a klatrinmediált internalizáció vagy a receptor-újrahasznosítás rendellenességeiben is érintett lehet a módosult funkciójú moezin.[11] A vezikulumok szállításához a moezinnek F-aktinhoz kell kötődnie.[11]
uPAR-szabályzás
A moezin és a merlin szabályozzák az urokinázreceptor-dependens endotélsejt-vándorlást, -adhéziót és angiogenezist. Feltehetően a moezinen keresztül aktiválja az uPAR az integrineket.[12] A merlin ezeket gátolja, ugyanis expressziója csökkentése növeli a fibroonektin- és vibronektinkötő integrinek szabályzása révén a sejtek vándorlását és adhézióját.[12]
Ras-szabályzás
A moezin részt vesz a SOS aktivitásának irányításában, mely fontos a normál Ras-funkcióban és bizonyos ráktípusokban a Ras-diszfunkció oka.[13]
Klinikai jelentősége
Krónikus veseelégtelenség
A moezin szerepet játszhat a vesefibrózisban, a krónikus veseelégtelenség utolsó szakaszában. 2014-ben kínai kutatók patkányokon kimutatták, hogy a TGF-β1 növeli a moezint és az α-SMA-t, és csökkenti az E-kadherint.[14] Bár már 2010-ben kimutatták, hogy a moezinfoszforiláció fontos lehet a TGF-β1-indukált humán tubuláris epitélsejt-károsodásban, de csak 2014-ben vizsgálták ennek molekuláris hátterét.[14] A moezin foszforilációja és az Erk 1/2-től függ, ezt a TGF-β aktiválja.[14]
A köldökvéna endotél sejtjeinek angiogenezise
A köldökvéna endotél sejtjeinek (HUVEC) előrehaladott glikációs végtermékek (AGE) miatti angiogenezisében fontos lehet a moezin Thr558-jának a foszforilációja, ez az F-aktin átrendeződését, stresszrost keletkezését, a sejtközi kötés zavarát okozza, az endotél gát diszfunkcióját okozva és növelve az érpermeabilitást.[15]
A RhoA-aktivitás adenovírus általi vagy a ROCK-aktiváció Y27632-vel való gátlása csökkenti az AGE-indukált moezinfoszforilációt, így a HUVEC-angiogenezist is. Ez alapján a Thr558-foszforiláció mediálja az endotél angiogenezist.[15] Tehát a RhoA/ROCK-útvonal fontos a moezinfoszforilációban és az AGE-indukált angiogenezisben.[15]
A moezin-siRNS-transzfekció csökkenti a moezin expresszióját, a HUVEC-csőképződést és a sebgyógyulást az életképesség csökkenése nélkül, így feltehetően a moezin fontos az angiogenezis során létrejövő sejtmozgásban.[15]
Tumorok
Bőrrák
A CPI-17 az onkogén Ras-jelzést befolyásolja az ERM családba tartozó fehérjék, például a moezin révén.[16]
A MYPT1 szabályozza az ERM-foszforilációt, ezt gátolja a CPI-17, ami a merlin nagyobb foszforiláció miatti inaktivitása esetén tumorigén hatást válthat ki.[16] Az ERM-fehérjékkel szemben a merlin a Ras-jelzőutat a Ras gátlásával gátolja, a CPI-17 pedig a merlin inaktívvá tétele mellett az ERM-fehérjék aktiválásával is onkogén hatást fejthet ki.[16]
Glioblastoma
Glioblastoma (GB) esetén a sejtek hialuronsav-indukált vándorlását szabályozhatja a moezin.[17] A hialuronsav fontos glükózaminoglikán a tumor-mikrokörnyezetekben, receptorával, a CD44-gyel alkotott komplexe számos tumorban okozhatja a sejtek behatolását, vándorlását és kemoterápiának való ellenállását.[17]
Laphámsejtes szájüregrák
Egy 2018-as tanulmány szerint a laphámsejtes szájüregrák sejtjeinek moezinexpressziója segíthet előrejelezni a rák előrehaladását.[18] A kutatásban csak a moezin mutatott statisztikailag szignifikáns különbséget.[18]
ER-pozitív mellrák
A moezin fontos biomarker a mellrák kialakulásában is, és a fibroadenómától függetlennek bizonyult egy 2018-as tanulmányban:[19] a moezinexpresszió-növekedést a mellrákos szövetek 47,8%-ában mutatták ki, a fibroadenómás szöveteknek viszont 30,4%-ában.[19] A moezin előrehaladottabb daganatok esetén nagyobb mennyiségben expresszálódott.[19] Azonban ER-negatív mellrák esetén nem találtak jelentős eltérést az alacsony moezinexpresszió és a hosszabb túlélés között, ER-pozitív esetén viszont szignifikáns volt az eltérés.[19]
Szepszis
A moezin fontos biomarkere az endotél sérülésnek szepszis esetén.[20] Mennyisége szepszises betegek vérszérumában az egészségeseknél nagyobb, az összefüggés a SOFA-pontszámokkal és a szérum-PCT-vel pozitív.[20] Ennek oka a ROCK1/MLC- és NF-κB szignál aktiválása.[20]
Egyes faktorok, például a TNF-α, a trombin és az előrehaladott glikációs végtermékek aktiválhatják az erek endotél sejtjeit, és foszforilálhatják az MSN-t az endotél sejtek permeabilitásának növeléséhez. Továbbá a lipopoliszacharidok stimulálhatják az endotél sejtek MSN-szekrécióját. Az MSN szükséges a HMG box-indukált endotélsejt-hiperpermeabilitáshoz és a gyulladásos válaszhoz, ezért és a szepszises emberekben és egerekben észlelt magas vér-MSN-szint alapján az MSN részt vesz a szepszis patogenezisében, így hasznos biomarker lehet annak vizsgálatában.[20]
Kölcsönhatások
A moezin az alábbi fehérjékkel lép kölcsönhatásba:
- CD43[21][22]
- ICAM3[23][24]
- Citoszol-neutrofilfaktor 1,[25]
- Citoszol-neutrofilfaktor 4[25]
- VCAM-1[26]
- EZR[27][28][29]
- LRRK2[30]
- PSGL-1[4]
- BRCA1[31]
Jegyzetek
- ↑ Lankes WT, Furthmayr H (1991. október 1.). „Moesin: a member of the protein 4.1-talin-ezrin family of proteins”. Proc. Natl. Acad. Sci. U.S.A. 88 (19), 8297–301. o. DOI:10.1073/pnas.88.19.8297. PMID 1924289.
- ↑ Amieva MR, Furthmayr H (1995. szeptember 1.). „Subcellular localization of moesin in dynamic filopodia, retraction fibers, and other structures involved in substrate exploration, attachment, and cell-cell contacts”. Exp. Cell Res. 219 (1), 180–96. o. DOI:10.1006/excr.1995.1218. PMID 7628534.
- ↑ a b Entrez Gene: MSN moesin
- ↑ a b Serrador JM, Urzainqui A, Alonso-Lebrero JL, Cabrero JR, Montoya MC, Vicente-Manzanares M, Yáñez-Mó M, Sánchez-Madrid F (2002. május 15.). „A juxta-membrane amino acid sequence of P-selectin glycoprotein ligand-1 is involved in moesin binding and ezrin/radixin/moesin-directed targeting at the trailing edge of migrating lymphocytes”. Eur J Immunol. DOI:<1560::AID-IMMU1560>3.0.CO;2-U 10.1002/1521-4141(200206)32:6<1560::AID-IMMU1560>3.0.CO;2-U. PMID 12115638. (Hozzáférés: 2023. december 17.)
- ↑ a b c Iontcheva I, Amar S, Zawawi KH, Kantarci A, van Dyke TE (2004. április). „Role for Moesin in Lipopolysaccharide-Stimulated Signal Transduction”. Infect Immun 72 (4), 2312–2320. o. DOI:10.1128/IAI.72.4.2312-2320.2004. PMID 15039356. (Hozzáférés: 2023. december 16.)
- ↑ a b c d Pearson MA, Reczek D, Bretscher A, Karplus PA (2000. április 28.). „Structure of the ERM Protein Moesin Reveals the FERM Domain Fold Masked by an Extended Actin Binding Tail Domain”. Cell 101 (3), 259–270. o. DOI:10.1016/S0092-8674(00)80836-3. PMID 10847681. (Hozzáférés: 2023. december 17.)
- ↑ Zawawi KH, Kantarci A, Schulze-Späte U, Fujita T, Batista EL, Amar S, van Dyke TE (2010. október). „Moesin-induced signaling in response to lipopolysaccharide in macrophages”. J Periodontal Res 45 (5), 589–601. o, Kiadó: Wiley. DOI:10.1111/j.1600-0765.2010.01271.x. PMID 20546116. (Hozzáférés: 2023. december 17.)
- ↑ a b c d Ben-Aissa K, Patino-Lopez G, Belkina NV, Maniti O, Rosales T, Hao J-J, Kruhlak MJ, Knutson JR, Picart C, Shaw S (2012. március 20.). „Activation of Moesin, a Protein That Links Actin Cytoskeleton to the Plasma Membrane, Occurs by Phosphatidylinositol 4,5-bisphosphate (PIP2) Binding Sequentially to Two Sites and Releasing an Autoinhibitory Linker”. J Biol Chem 287 (20), 16311–16323. o. DOI:10.1074/jbc.M111.304881. PMID 22433855.
- ↑ Rahimi N, Ho RXY, Chandler KB, de la Cena KOC, Amraei R, Mitchel AJ, Engblom N, Costello CE (2021. szeptember 9.). „The cell adhesion molecule TMIGD1 binds to moesin and regulates tubulin acetylation and cell migration”. J Biomed Sci 28. DOI:10.1186/s12929-021-00757-z. (Hozzáférés: 2023. december 18.)
- ↑ a b Lee JH, Yoo JH, Oh SH, Lee KY, Lee KH (2010. május). „Knockdown of Moesin Expression Accelerates Cellular Senescence of Human Dermal Microvascular Endothelial Cells”. Yonsei Med J 51 (3), 438–447. o, Kiadó: Yonsei University College of Medicine. DOI:10.3349/ymj.2010.51.3.438.
- ↑ a b c d Barroso-González J, Machado J-D, García-Expósito L, Valenzuela-Fernández A (2009. január 23.). „Moesin Regulates the Trafficking of Nascent Clathrin-coated Vesicles”. J Biol Chem. DOI:10.1074/jbc.M805311200. PMID 19047065. (Hozzáférés: 2023. december 17.)
- ↑ a b Degryse B, Britto M, Shan CX, Wallace RG, Rochfort KD, Cummins PM, Meade G, Murphy RP (2017. július). „Moesin and merlin regulate urokinase receptor-dependent endothelial cell migration, adhesion and angiogenesis”. Int J Biochem Cell Biol 88, 14–22. o. DOI:10.1016/j.biocel.2017.04.012. PMID 28473293. (Hozzáférés: 2023. december 17.)
- ↑ Sperka T, Geißler KJ, Merkel U, Scholl I, Rubio I, Herrlich P, Morrison HL (2011. november 21.). „Activation of Ras Requires the ERM-Dependent Link of Actin to the Plasma Membrane”. PLoS ONE 6 (11), e27511. o. DOI:10.1371/journal.pone.0027511. PMID 22132106. (Hozzáférés: 2023. december 18.)
- ↑ a b c Chen Y-X, Zhang W, Wang W-M, Yu X-L, Wang Y-M, Zhang M-J, Chen N (2014. november 18.). „Role of moesin in renal fibrosis”. PLoS ONE 9 (11), e112936. o. DOI:10.1371/journal.pone.0112936. PMID 25406076. (Hozzáférés: 2023. december 16.)
- ↑ a b c d Wang Q, Fan A, Yuan Y, Chen L, Guo X, Huang X, Huang Q (2016. március 9.). „Role of Moesin in Advanced Glycation End Products-Induced Angiogenesis of Human Umbilical Vein Endothelial Cells”. Sci Rep 6, 22749. o. DOI:10.1038/srep22749. PMID 26956714. (Hozzáférés: 2023. december 16.)
- ↑ a b c Riecken LB, Zoch A, Wiehl U, Reichert S, Scholl I, Cui Y, Ziemer M, Anderegg U, Hagel C, Morrison H (2016. november 29.). „CPI-17 drives oncogenic Ras signaling in human melanomas via Ezrin-Radixin-Moesin family proteins”. Oncotarget 7 (48), 78242–78254. o. DOI:10.18632/oncotarget.12919. PMID 27793041. (Hozzáférés: 2023. december 18.)
- ↑ a b DeSouza LV, Matta A, Karim Z, Mukherjee J, Wang XS, Krakovska A, Zadeh G, Guha A, Siu KWM (2013. július 15.). „Role of moesin in hyaluronan induced cell migration in glioblastoma multiforme”. Mol Cancer. DOI:10.1186/1476-4598-12-74. PMID 23855374. (Hozzáférés: 2023. december 16.)
- ↑ a b Barros FBA, Garcia NG, Nonogaki S, Carvalho AL, Soares FA, Kowalski LP, Oliveira DT (2018. január 8.). „Moesin expression by tumor cells is an unfavorable prognostic biomarker for oral cancer”. BMC Cancer 18. DOI:10.1186/s12885-017-3914-0. PMID 29310601. (Hozzáférés: 2023. december 17.)
- ↑ a b c d Yu L, Zhao L, Wu H, Zhao H, Yu Z, He M, Jin F, Wei M (2018. december 6.). „Moesin is an independent prognostic marker for ER-positive breast cancer”. Oncol Lett 17 (2), 1921–1933. o. DOI:10.3892/ol.2018.9799. PMID 30675256. (Hozzáférés: 2023. december 17.)
- ↑ a b c d Chen Y, Wang J, Zhang L, Zhu J, Zeng Y, Huang J-A (2021. február 13.). „Moesin is a Novel Biomarker of Endothelial Injury in Sepsis”. J Immunol Res 2021, 6695679. o. DOI:10.1155/2021/6695679. PMID 33628853. (Hozzáférés: 2023. december 17.)
- ↑ Serrador JM, Nieto M, Alonso-Lebrero JL, del Pozo MA, Calvo J, Furthmayr H, Schwartz-Albiez R, Lozano F, González-Amaro R, Sánchez-Mateos P, Sánchez-Madrid F (1998. június 1.). „CD43 interacts with moesin and ezrin and regulates its redistribution to the uropods of T lymphocytes at the cell-cell contacts”. Blood 91 (12), 4632–44. o. DOI:10.1182/blood.V91.12.4632. PMID 9616160.
- ↑ Yonemura S, Hirao M, Doi Y, Takahashi N, Kondo T, Tsukita S, Tsukita S (1998. február 1.). „Ezrin/radixin/moesin (ERM) proteins bind to a positively charged amino acid cluster in the juxta-membrane cytoplasmic domain of CD44, CD43, and ICAM-2”. J. Cell Biol. 140 (4), 885–95. o. DOI:10.1083/jcb.140.4.885. PMID 9472040.
- ↑ Serrador JM, Alonso-Lebrero JL, del Pozo MA, Furthmayr H, Schwartz-Albiez R, Calvo J, Lozano F, Sánchez-Madrid F (1997. szeptember 1.). „Moesin interacts with the cytoplasmic region of intercellular adhesion molecule-3 and is redistributed to the uropod of T lymphocytes during cell polarization”. J. Cell Biol. 138 (6), 1409–23. o. DOI:10.1083/jcb.138.6.1409. PMID 9298994.
- ↑ Serrador JM, Vicente-Manzanares M, Calvo J, Barreiro O, Montoya MC, Schwartz-Albiez R, Furthmayr H, Lozano F, Sánchez-Madrid F (2002. március 1.). „A novel serine-rich motif in the intercellular adhesion molecule 3 is critical for its ezrin/radixin/moesin-directed subcellular targeting”. J. Biol. Chem. 277 (12), 10400–9. o. DOI:10.1074/jbc.M110694200. PMID 11784723.
- ↑ a b Wientjes FB, Reeves EP, Soskic V, Furthmayr H, Segal AW (2001. november 1.). „The NADPH oxidase components p47(phox) and p40(phox) bind to moesin through their PX domain”. Biochem. Biophys. Res. Commun. 289 (2), 382–8. o. DOI:10.1006/bbrc.2001.5982. PMID 11716484.
- ↑ Barreiro O, Yanez-Mo M, Serrador JM, Montoya MC, Vicente-Manzanares M, Tejedor R, Furthmayr H, Sanchez-Madrid F (2002. június 1.). „Dynamic interaction of VCAM-1 and ICAM-1 with moesin and ezrin in a novel endothelial docking structure for adherent leukocytes”. J. Cell Biol. 157 (7), 1233–45. o. DOI:10.1083/jcb.200112126. PMID 12082081.
- ↑ Gajate C, Mollinedo F (2005. március 1.). „Cytoskeleton-mediated death receptor and ligand concentration in lipid rafts forms apoptosis-promoting clusters in cancer chemotherapy”. J. Biol. Chem. 280 (12), 11641–7. o. DOI:10.1074/jbc.M411781200. PMID 15659383.
- ↑ Gary R, Bretscher A (1995. augusztus 1.). „Ezrin self-association involves binding of an N-terminal domain to a normally masked C-terminal domain that includes the F-actin binding site”. Mol. Biol. Cell 6 (8), 1061–75. o. DOI:10.1091/mbc.6.8.1061. PMID 7579708.
- ↑ Gary R, Bretscher A (1993. november 1.). „Heterotypic and homotypic associations between ezrin and moesin, two putative membrane-cytoskeletal linking proteins”. Proc. Natl. Acad. Sci. U.S.A. 90 (22), 10846–50. o. DOI:10.1073/pnas.90.22.10846. PMID 8248180.
- ↑ Dusonchet J, Li H, Guillily M, Liu M, Stafa K, Troletti CD, Boon JY, Saha S, Glauser L, Mamais A, Citro A, Youmans KL, Liu LQ, Schneider BL, Aebischer P, Yue Z, Bandopadhyay R, Glicksman MA, Moore DJ, Collins JJ, Wolozini B (2014. szeptember 15.). „A Parkinson's disease gene regulatory network identifies the signaling protein RGS2 as a modulator of LRRK2 activity and neuronal toxicity”. Hum Mol Genet 23 (18), 4887–4905. o. DOI:10.1093/hmg.ddu202. PMID 24794857. (Hozzáférés: 2023. december 16.)
- ↑ Coene ED, Gadelha C, White N, Malhas A, Thomas B, Shaw M, Vaux DJ (2011. február 7.). „A novel role for BRCA1 in regulating breast cancer cell spreading and motility”. J Cell Biol 192 (3), 497–512. o. DOI:10.1083/jcb.201004136. PMID 21282464. (Hozzáférés: 2023. december 18.)
Fordítás
Ez a szócikk részben vagy egészben a Moesin című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
- Tsukita S, Yonemura S (1997). „ERM (ezrin/radixin/moesin) family: from cytoskeleton to signal transduction”. Curr. Opin. Cell Biol. 9 (1), 70–5. o. DOI:10.1016/S0955-0674(97)80154-8. PMID 9013673.
- Vaheri A, Carpén O, Heiska L, Helander TS, Jääskeläinen J, Majander-Nordenswan P, Sainio M, Timonen T, Turunen O (1997). „The ezrin protein family: membrane-cytoskeleton interactions and disease associations”. Curr. Opin. Cell Biol. 9 (5), 659–66. o. DOI:10.1016/S0955-0674(97)80119-6. PMID 9330869.
- Matarrese P, Malorni W (2005). „Human immunodeficiency virus (HIV)-1 proteins and cytoskeleton: partners in viral life and host cell death”. Cell Death Differ. 12 Suppl 1, 932–41. o. DOI:10.1038/sj.cdd.4401582. PMID 15818415.
- Gary R, Bretscher A (1995). „Ezrin self-association involves binding of an N-terminal domain to a normally masked C-terminal domain that includes the F-actin binding site”. Mol. Biol. Cell 6 (8), 1061–75. o. DOI:10.1091/mbc.6.8.1061. PMID 7579708.
- Schwartz-Albiez R, Merling A, Spring H, Möller P, Koretz K (1995). „Differential expression of the microspike-associated protein moesin in human tissues”. Eur. J. Cell Biol. 67 (3), 189–98. o. PMID 7588875.
- Schneider-Schaulies J, Dunster LM, Schwartz-Albiez R, Krohne G, ter Meulen V (1995). „Physical association of moesin and CD46 as a receptor complex for measles virus”. J. Virol. 69 (4), 2248–56. o. DOI:10.1128/JVI.69.4.2248-2256.1995. PMID 7884872.
- Wilgenbus KK, Hsieh CL, Lankes WT, Milatovich A, Francke U, Furthmayr H (1994). „Structure and localization on the X chromosome of the gene coding for the human filopodial protein moesin (MSN)”. Genomics 19 (2), 326–33. o. DOI:10.1006/geno.1994.1065. PMID 8188263.
- Gary R, Bretscher A (1993). „Heterotypic and homotypic associations between ezrin and moesin, two putative membrane-cytoskeletal linking proteins”. Proc. Natl. Acad. Sci. U.S.A. 90 (22), 10846–50. o. DOI:10.1073/pnas.90.22.10846. PMID 8248180.
- Dunster LM, Schneider-Schaulies J, Löffler S, Lankes W, Schwartz-Albiez R, Lottspeich F, ter Meulen V (1994). „Moesin: a cell membrane protein linked with susceptibility to measles virus infection”. Virology 198 (1), 265–74. o. DOI:10.1006/viro.1994.1029. PMID 8259662.
- Nakamura F, Amieva MR, Furthmayr H (1995). „Phosphorylation of threonine 558 in the carboxyl-terminal actin-binding domain of moesin by thrombin activation of human platelets”. J. Biol. Chem. 270 (52), 31377–85. o. DOI:10.1074/jbc.270.52.31377. PMID 8537411.
- Ott DE, Coren LV, Kane BP, Busch LK, Johnson DG, Sowder RC, Chertova EN, Arthur LO, Henderson LE (1996). „Cytoskeletal proteins inside human immunodeficiency virus type 1 virions”. J. Virol. 70 (11), 7734–43. o. DOI:10.1128/JVI.70.11.7734-7743.1996. PMID 8892894.
- Hecker C, Weise C, Schneider-Schaulies J, Holmes HC, ter Meulen V (1997). „Specific binding of HIV-1 envelope protein gp120 to the structural membrane proteins ezrin and moesin”. Virus Res. 49 (2), 215–23. o. DOI:10.1016/S0168-1702(97)00039-7. PMID 9213396.
- Serrador JM, Alonso-Lebrero JL, del Pozo MA, Furthmayr H, Schwartz-Albiez R, Calvo J, Lozano F, Sánchez-Madrid F (1997). „Moesin interacts with the cytoplasmic region of intercellular adhesion molecule-3 and is redistributed to the uropod of T lymphocytes during cell polarization”. J. Cell Biol. 138 (6), 1409–23. o. DOI:10.1083/jcb.138.6.1409. PMID 9298994.
- Reczek D, Berryman M, Bretscher A (1997). „Identification of EBP50: A PDZ-containing phosphoprotein that associates with members of the ezrin-radixin-moesin family”. J. Cell Biol. 139 (1), 169–79. o. DOI:10.1083/jcb.139.1.169. PMID 9314537.
- Murthy A, Gonzalez-Agosti C, Cordero E, Pinney D, Candia C, Solomon F, Gusella J, Ramesh V (1998). „NHE-RF, a regulatory cofactor for Na(+)-H+ exchange, is a common interactor for merlin and ERM (MERM) proteins”. J. Biol. Chem. 273 (3), 1273–6. o. DOI:10.1074/jbc.273.3.1273. PMID 9430655.
- Yonemura S, Hirao M, Doi Y, Takahashi N, Kondo T, Tsukita S, Tsukita S (1998). „Ezrin/radixin/moesin (ERM) proteins bind to a positively charged amino acid cluster in the juxta-membrane cytoplasmic domain of CD44, CD43, and ICAM-2”. J. Cell Biol. 140 (4), 885–95. o. DOI:10.1083/jcb.140.4.885. PMID 9472040.
