Szerkesztő:FUBXAAO/próbalap
Kollagén
Neve görög eredetű,a görög κόλλα (kólla) szóból ered,mely ragasztót jelent.Az állatvilág egyik legelterjedtebb fehérjéje.Fontos szerepet játszik a sejtek közötti tér,extracelluláris mátrix felépítésében,a csontok rugalmasságában,a porcszövet felépítésében.Strukturális fehérje,mely vízben gyakorlatilag oldhatatlan,azonban savakkal és lúggal oldható.Fibrilláris térkitöltésű fehérje,jellegzetes hullámos lefutással,változó rostátmérővel (2-20 mikrométer).Melegítés,főzés hatására kocsonyás enyvet ereszt,mely igen nagy térfogatú vizet képes megkötni,ezt a tulajdonságát használjuk fel a gasztronómiában kocsonyakészítésnél.Emberben nagy molekulacsaládot alkot,több típusa ismert:25 féle kollagénmolekulát különböztetünk meg,melyeket római számokkal jelölünk.

Molekuláris felépítés[szerkesztés]
A kollagénrostot elemi fibrillumok építik fel,melyeket elektronmikroszkóppal megfigyelve periodikusan váltakozó sötét és világos harántcsíkolatot mutatnak.Vízben nem,de savas közegben a fibrillumok közötti kovalens kötések felszakíthatóak,tropokollagén molekulákra esnek szét.Ezek a molekulák 290 nm hosszúságúak,és 1,5 nm szélesek és két szomszédos fibrillum között a kollagénrostban 40 nm-es hézag található.Jellemző rájuk a tripla helikális szerkezet,három egymás köré tekeredő alfa polipeptid láncból épül fel,melyek hidroxilált aminosavai között másodrendű hidrogén-kötések teremtenek kapcsolatot és tartják össze a tripla hélixet.A polipeptid láncban nagy szerepe van a lizin és prolin aminosavaknak,ezek oldalláncai fognak hidroxilálódni (hidroxilizin,hidroxiprolin),valamint minden harmadik aminosav glicin mert ez adja a hajlékonyságot.
RGD szekvencia[szerkesztés]
A legtöbb kollagénmolekulában jelként müködő tripeptidszakasz (RGD:arginin-glicin-aszpartát) található,melyet a kötőszöveti sejtek integrin típusú receptoraik segítségével felismernek,és ahhoz kötődhetnek.A kötődés következményeként a sejt hozzátapad a kollagénhez,és azon vándorolhat,sőt a kapcsolat osztódást vagy differenciálódást is elindíthat.A thrombocyták (vérlemezkék) is tartalmaznak a membránjukban integrineket,aminek többek között az a jelentősége,hogy az ér endothel sérülése esetén a vérlemezkék a szabaddá váló kollagénrostokhoz kapcsolódnak,mintegy "tamponálva" a sérülés helyét.[1]
Szintézis[szerkesztés]

A kollagénrost szintézise hasonlóan más fehérjékhez,a durva felszínű endoplazmatikus retikulum (DER) felszínén kezdődik.A lumenbe jutott szolubilis prokollagén fehérje különböző poszttranszlációs módosulásokon megy keresztül.A prolin és lizin oldalláncai hidroxilálódnak (hidroxiprolin,hidroxilizin),majd a polipeptidlánc glikozilálódik.A hidroxiláció C vitamingényes folyamat,hiányában nem megy végbe.Klinikai relevanciáját adja skorbutban,mikor a C vitamin hiány következtében a prolin,lizin aminosavak nem képesek hidroxilálódni így sérül a szintézis.A prokollagén molekulák nem képesek kialakítani a tripla hélix struktúrát,majd degradálódnak.A kollagénrostok hiánya vezet az erek,inak,bőr sérülékenységéhez.A hidroxilált prokollagén intracelluláris transzportvezikulákkal a Golgi komplexbe jut,ahol glikozilálódik.Ezt követően az extracelluláris térbe kerül exocitózissal,itt a a prokollagén N- és C- terminális végén lehasítódik egy-egy gátló polipeptidszakasz,létrejön a tropokollagén.Ezután tudnak kovalens keresztkötések kialakulni a tropokollagén molekulák között,végül kollagénrostot alkotva.[2]
Kollagén típusok,kódoló gének,hibák[szerkesztés]
A legtöbb kollagénnel kapcsolatos kórkép oka a kódoló gének hibája,vagy a szintézis szenved zavart a poszttranszlációs módosulás,szekréció során.
| Típus | Leírás | Gén(ek) | Betegségek |
| I | A leggyakrabban előforduló típus az emberi szervezetben.Megtalálható a bőrben,erek falában,ínakban,szem szaruhártyájában,fogakban. | COL1A1, COL1A2 | Osteogenesis imperfecta,Ehlers–Danlos szindróma,Infantilis corticalis hyperostosis (Caffey-betegség) |
| II | Porcok fő alkotója,megtalálható a porckorongokban,sőt a csarnokvízben is. | COL2A1 | Kollagenopathia (2-es és 11-es típusú) |
| III | Másnéven rácsrost.A kötőszöveti fibrociták,reticulumsejtek termelik,megtalálható a bazál membránban,nyirokszövetek vázát alkotó retikuláris kötőszövetben.Igen vékony rostátmérővel rendelkezik. | COL3A1 | Ehlers–Danlos szindróma, Dupuytren kontraktúra |
| IV | A bazál membrán lamina densa rétegét alkotja,előfordul a kapillárisok falában,a vese glomerulusaiban. | COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 | Alport szindróma, Goodpasture betegség |
| V | Placentában. | COL5A1, COL5A2, COL5A3 | Ehlers–Danlos szindróma |
| VI | Az I-es típusúval asszociáltan fordul elő. | COL6A1, COL6A2, COL6A3, COL6A5 | Ulrich myopathia, Bethlem myopathia, Atopic dermatitis |
| VII | Horgonyzó,kötőfehérje. | COL7A1 | Epidermolysis bullosa dystrophica |
| VIII | Endothel sejtekben. | COL8A1, COL8A2 | Posterior polymorphous corneal dystrophy 2,PPMD betegség |
| IX | Porcokban található,II-es típusú kollagénnel asszociáltan. | COL9A1, COL9A2, COL9A3 | EDM2 és EDM3 |
| X | Porcokban. | COL10A1 | Schmid metaphyseal dysplasia |
| XI | Porcokban. | COL11A1, COL11A2 | Kollagenopathia (2-es és 11-es típusú |
| XII | - | COL12A1 | – |
| XIII | Transzmembrán fehérje. | COL13A1 | – |
| XIV | Undulin | COL14A1 | – |
| XV | – | COL15A1 | – |
| XVI | – | COL16A1 | – |
| XVII | Transzmembrán fehérjék. | COL17A1 | Bullous pemphigoid,epidermolysis bullosa |
| XVIII | endostatin | COL18A1 | – |
| XIX | - | COL19A1 | – |
Klinikai vonatkozások[szerkesztés]
A lumenben lejátszódó hidroxiláció nagy szerepet kap a szekrécióra kerülő kollagén termostabil triplahelikális szerkezetének kialakításában.A prolin hidroxilációja a kollagén-prolin-4-hidroxiláz (C-P4H) által katalizált reakcióban X-Pro-Gly tripletmotívumokon történik.A folyamat zavartalan lejátszódásához az enzim 2-oxoglutarát, oxigén, Fe2+ és aszkorbát kofaktorokat igényel.
A C-P4H szerkezete α2β2 heterotetramer,amelynek β-alegysége a fehérjefolding folyamatában kiemelt szereppel bíró PDI (Protein Diszulfid Izomeráz).
A lizin hidroxilációja a homodimer lizin-5-hidroxiláz (L5H) katalizálta reakció során X-Lys-Gly motívumokon történik.A folyamat zavartalan lejátszódásához az enzim kofaktorigénye megegyezik a C-P4H-val.Számos patológiás,a kötőszövetet érintő betegség köthető a L5H-t kódoló génekhez.Az L5H-1 izoformát kódoló PLOD1 gén mutációja kyphoscoliosis (Ehlers-Danlos Szindróma VI-os típus, EDS VI) kialakulásával jár,míg az L5H-2 izoforma PLOD2 mutációja a Bruck 2-es szindrómával hozható összefüggésbe,amelyben a lizin oldalláncok csökkent mértékű hidroxilációja figyelhető meg.[3]
Skorbut[szerkesztés]
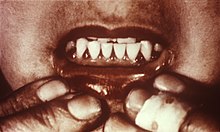
A fent említett hidroxilációs reakciók csökkent aszkorbát mennyiség mellett alulműködnek, és patológiás esetekhez vezetnek,például skorbuthoz.A skorbut legjellemzőbb tünetei a fragilis erek, fogvesztés,ínysorvadás,lassú sebgyógyulás,már bezáródott sebek újra kinyílása,csontfájdalmak,csontleépülés, szívelégtelenség,enyhébb hiány esetében,gyengeség,légúti fertőző betegségek kialakulása.
Knobloch szindróma[szerkesztés]
A XVIII-as típusú kollagént kódoló COL18A1 gén autoszomális recesszív mutációja figyelhető meg Knobloch szindrómában,mely igen ritka genetikai betegség.Extrém myopiával (rövidlátás),cataractával (szürkehályog) retina degenerációval jár együtt leggyakrabban.[4]
Ehlers-Danlos szindróma[szerkesztés]
Az Ehlers-Danlos Syndroma (EDS) világszerte ötezerből egy embert érint.[5] A túlzott mobilitás jelenségét először Hippokratész írta le 400-ban.A szindróma két orvosról,a dán Edvard Ehlersről és a francia Henri-Alexandre Danlosról kapta a nevét,akik a 20. század fordulóján írták le az állapotot.A jelek nagy eltéréseket mutatnak attól függően,hogy melyik EDS típusról van szó.Legjellemzőbb tünetei az instabil tág határok között mozgatható ízületek,igen nyúlékony és sérülékeny bőr,könnyen keletkező véraláfutások,szívbillentyűhibák.
Osteogenesis imperfecta[szerkesztés]
Az Osteogenesis imperfecta igen ritka öröklődő megbetegedés,amely a kötőszövet fő alkotóelemének, az I típusú kollagénnek, mennyiségi és/vagy minőségi összetételében beállt változás következtében jön létre.A leggyakoribb genetikai eltérés az láncot kódoló COL1A1 és COL1A2 gén defektusa következtében jön létre.Férfiakat és nőket egyaránt érint.A genetikai hátterét tekintve autoszomális domináns és recesszív formákat különítünk el.A spontán mutáció mellett mozaicizmus is szerepet játszik létrejöttében.Klinikai tünetei közül a csontrendszert érintőek a meghatározók,pathológiás törések, ill. azok következményes deformitásai folytán.A mozgásszervi károsodások és a fájdalom a beteg életét behatárolja, életminőségét rontja.Csontrendszeri tünetek: gyakori, minimális behatásra bekövetkező csonttörések, azok gyakori deformitásokkal való gyógyulása, a terhelésnek kitett csontok alaki változása, elgörbülése.A kötőszövet érintettsége következtében, szinte minden szövetet érintett.A bőr szakadékony, az ízületek lazák, gyakoriak a sérvek. Mindezek a mozgások beszűküléséhez, kontrakturákhoz vezetnek, a beteg kerekesszékbe kényszerülhet.A sérülésekkel jelentkező fájdalom a deformálódással párhuzamosan állandósulhat.A szem ínhártyája gyakran kék, pubertás után vezetéses halláscsökkenés alakulhat ki.Előfordulhatnak még dentinképződési zavarok korai fogvesztéssel,szívbillentyű zavarok.[6]
Infantilis corticalis hyperostosis[szerkesztés]
Másnéven Caffey betegség,melyben az I-es típusú kollagént kódoló COL1A1 gén autoszomális domináns mutációja kimutatható.A 35. gesztációs hét előtt letális.[7]A betegség típusosan csecsemőkorban jelentkezik, általában még 6 hónapos kor előtt.Lázzal,magas fehérvérsejtszámmal,és emelkedett vörösvértest süllyedés értékkel. A gyermekre ingerlékenység,általános rossz közérzet jellemző.Lágyrész duzzanatok alakulnak ki a lapos csontok vetületében, különösképpen az alsó állkapocs és kulcscsont felett,illetve a hosszú csöves csontok vége felett.Ezek a duzzanatok kemény tapintatúak és fájdalmasak, de a bőr felettük nem melegebb,illetve nem duzzadnak meg a közeli nyirokcsomók sem.A csontrendszer csaknem minden csontjának érintettsége ismert már, kivéve a csigolyákét, de a betegség szintén ritkán érinti még a kéz és láb kis csöves csontjait is.A duzzanat eltűnhet az egyik helyen és megjelenhet a másikon.A csontbiopszia az újdonképzett csont mennyiségének növekedését mutatja, de nincs egyértelmű jel a gyulladásos folyamatra.A lágyrész duzzanatok 3-4 hónap alatt megszűnhetnek, de a csontos "duzzanatok" tovább megmaradhatnak.A kórkép családi halmozódást mutat a genetikai érintettség miatt.A radiológiai kép jellegzetes: kifejezett az új csont növekedése,ami döntően vagy teljes egészében a csont végére lokalizálódik. Az új csont külső felszíne durva, vaskos és egyenetlen. Az érintett csont a végén kiszélesedik.Amikor megkezdődik a gyógyulás, az újdonképzett csont lamelláris szerkezetűvé válik,majd fokozatosan visszanyeri eredeti alakját.[8]
Hivatkozások[szerkesztés]
- ↑ Prof.Dr. Röhlich Pál:Szövettan Semmelweis Kiadó 2006
- ↑ Prof.Dr. Szeberényi József: Molekuláris sejtbiológia, 3., átdolg. kiad., Dialóg Campus Kiadó, Budapest-Pécs, 2011.
- ↑ Szarka András – Bánhegyi Gábor:Patobiokémia Typotex Kiadó 2014
- ↑ Mahajan, VB, Olney, AH, Garrett, P, Chary, A, Dragan, E, Lerner, G, Murray, J & Bassuk, AG; Olney; Garrett; Chary; Dragan; Lerner; Murray; Bassuk (2010). "Collagen XVIII mutation in Knobloch syndrome with acute lymphoblastic leukemia". American Journal of Medical Genetics Part A. 152A (11): 2875–9.
- ↑ "Ehlers-Danlos Syndrome" U.S National Library of Medicine
- ↑ Prof.Dr. Szendrői Miklós:Ortopédia Semmelweis Egyetem Ortopédiai Klinika 2011
- ↑ http://www.orpha.net/
- ↑ http://www.drdiag.hu
