Kombinatorikus kémia
Kombinatorikus kémia
A kombinatorikus kémia olyan kémiai szintézis módszeren alapul, amelyek lehetővé teszi nagyszámú (több millió, akár több milliárd) vegyület előállítását egyetlen folyamatban. Az ezúton képződő vegyülettárak lehetnek vegyületkeverékek, lehetnek egyedi vegyületek halmazai és lehetnek számítógépes szoftverrel előállított kémiai szerkezetek is.[1] A kombinatorikus szintézist általában peptidek vagy egyéb kismolekulás szerves vegyületek szintézisére használják. A kombinatorikus kémia részét képezik azok az eljárások is, amelyek lehetővé teszik a tárak szűrését, azaz a tárak biológiailag hatásos összetevőinek azonosítását. A kombinatorikus módszereket a kémián kívül is alkalmazzák.
Története
A kombinatorikus kémiát Furka Árpád professzor (Eötvös Loránd Tudományegyetem) találta fel, aki egy 1982-ben közjegyző által hitelesített dokumentumban leírta a szintézis elvét, a és a biológiailag hatásos vegyületek azonosításának egyik lehetséges módját.[2] A kombinatorikus módszer elve a következő: többkomponensű vegyülettárakat (kombinatorikus vegyülettár, angolul combinatorial library) szintetizálunk egyetlen lépésben és ugyancsak egy lépésben szűrés révén állapítjuk meg, hogy a tár komponensei közül melyeket lehet gyógyszer jelöltnek vagy egyéb hasznos vegyületnek tekinteni.. A kombinatorikus módszer legfontosabb újítása a keverékek alkalmazása a szintézisben és a szűrésben, mert ez biztosítja a folyamat rendkívül nagy termelékenységét. A találmányhoz vezető motivációkat egy 2002-es publikáció tartalmazza.[3]
A kombinatorikus megosztásos keveréses (angolul split and pool) szintézis

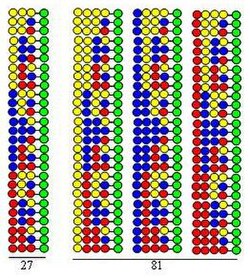
A kombinatorikus megosztásos keveréses szintézis[4][5] a Merrifield által kifejlesztett szilárd fázisú szintézisen alapul.[6] Ha például egy kombinatorikus peptidtárat 20 aminosav felhasználásával szintetizálnak, a szilárd hordozó szemcséit 20 egyenlő részre osztják. Ezt követi az egyes részekhez más-más aminosav kapcsolása. A harmadik lépés az összes rész összekeverése. Ez a három lépés egy ciklust foglal magában. A peptidláncok meghosszabbítása megvalósítható a ciklus lépéseinek egyszerű megismétlésével. A megosztásos keveréses kombinatorikus szintézis folyamatábrája
Az eljárást egy dipeptidtár szintézisével szemléltetjük, amely mindkét ciklusban ugyanazt a három aminosavat használja építőelemként. Ennek a tárnak minden komponense két aminosavat tartalmaz, amelyek különböző sorrendben vannak egymáshoz kapcsolva. A kapcsolásokban használt aminosavakat sárga, kék és piros körök jelölik az ábrán. Az elágazó nyilak a szilárd hordozó (zöld körök) egyenlő részekre történő osztását mutatják, a függőleges nyilak az összekapcsolást, az összetartó nyilak pedig a hordozó részeinek keverését és homogenizálását jelentik.
Az ábrán látható, hogy a két szintetikus ciklusban 9 dipeptid képződik. Ha egy harmadik és negyedik ciklust is végrehajtanánk, 27 tripeptid és 81 tetrapeptid képződne. A megosztásos keveréses szintézis számos kiemelkedő tulajdonsággal rendelkezik:
• Nagyon hatékony. Amint az ábrán látható, a szintetikus folyamatban képződő peptidek száma (3, 9, 27, 81) exponenciálisan növekszik a végrehajtott ciklusok számával. Minden szintetikus ciklusban 20 aminosavat használva a képződött peptidek száma: 400, 8000, 160000 és 3200000. Ez azt jelenti, hogy a peptidek száma exponenciálisan növekszik a végrehajtott ciklusok számával.
• A folyamat során az összes peptidszekvencia keletkezik, amely a ciklusokban használt aminosavak kombinációjából következtethető.
• A hordozó egyenlő mintákra történő felosztása biztosítja a tár komponenseinek közel azonos moláris mennyiségben történő képződését.
• A hordozó minden szemcséjén csak egyetlen peptid képződik. Ez annak a következménye, hogy csak egy aminosavat használunk a kapcsolási lépésekben. Teljesen ismeretlen azonban, hogy melyik peptid foglal el egy kiválasztott hordozószemcsét. Az olyan tárakat, amelynek hordozójáról a vegyületek nincsenek lehasítva Egy-Szemcse-Egy-Vegyület (angol rovidítéssel OBOC) táraknak nevezik.
• A megosztásos keveréses módszer alkalmazható bármilyen szerves vegyülettár szintézisére, amely építőelemeiből lépésenként állítható elő.
1990-ben három csoport ismertette a peptidtárak biológiai módszerekkel történő előállításának módszereit,[7][8][9] majd egy évvel később Fodor és munkatársai figyelemreméltó módszert publikáltak peptidtárak szintézisére kis üveglemezek felületén.[10]
Mario Geysen és munkatársai egy "párhuzamos szintézis" módszert fejlesztettek ki peptidtárak előállítására.[11] 96 peptidet szintetizáltak műanyag pálcákon (tűkön), amelyek végei szilárd hordozóval voltak bevonva be. A kapcsolásokat úgy végezték, hogy tűket egy mikrotiter lemez üregeibe helyezett reagensek oldatába merítették. Az eljárást széles körben alkalmazzák. Az automatikus párhuzamos szintetizátorok ezen az eljáráson alapulnak. Bár a párhuzamos módszer sokkal lassúbb, mint a valódi kombinatorikus, előnye, hogy pontosan ismert, hogy az egyes tűkön melyik peptid vagy más vegyület keletkezik.
További eljárásokat fejlesztettek ki az megosztásos keveréses és a párhuzamos szintézis előnyeinek kombinálására. A két csoport által leírt módszerben [12][13] [18][19] a szilárd hordozót félig áteresztő falú műanyag kapszulákba zárják, egy rádiófrekvenciás címkével együtt, amely a kapszulában képződő vegyület kódját hordozta. Az eljárást hasonló módon hajtották végre a megosztásos keverékes módszer. A megosztási lépésben azonban a kapszulákat a kapszulák rádiófrekvenciás címkéiből leolvasott kódok szerint osztották el a reakcióedények között. Furka és munkatársai ugyanerre a célra egy másik módszert dolgoztak ki,[14] [20] amelyet "zsinórszintézisnek" neveznek. Ennél a módszernél a kapszulák nem hordoztak kódot. Úgy vannak felfűzve, mint a gyöngyök egy nyakláncba, és felfűzve helyezik a reakcióedényekbe. A kapszulák azonosságát, valamint a tartalmukat a zsinórokon elfoglalt helyzetük mutatja. Minden egyes kapcsolási lépés után a kapszulákat meghatározott szabályok szerint újra elosztják az új zsinórok között.
A biológiailag hatásos összetevők azonosítása
Kombinatorikus vegyülettárak
A kombinatorikus vegyülettárak kis molekulájú kémiai vegyületek speciális többkomponensű keverékei, amelyeket egyetlen lépésben szintetizálnak. Különböznek az egyes vegyületek gyűjteményeitől, valamint a párhuzamos szintézissel előállított vegyületek sorozatától. Fontos jellemzőjük, hogy a szintézisükben keverékeket használnak. A keverékek használata biztosítja a folyamat nagyon magas hatékonyságát. Mindkét reagens lehet keverék, és ebben az esetben az eljárás még hatékonyabb lenne. Gyakorlati okokból azonban tanácsos a megosztásos keveréses módszert használni, amelyben a két keverék egyikét egyetlen építőelemre (blokkra) cserélik. A keverékek annyira fontosak, hogy nincsenek kombinatorikus tárak anélkül, hogy a szintézisben keveréket használnának, és ha keveréket használnak egy eljárásban, elkerülhetetlenül kombinatorikus vegyülettárak keletkeznek. A megosztásos keveréses szintézist általában szilárd hordozó segítségével valósítják meg, de megoldható oldatban is. Mivel a tárak komponensei ismeretlenek, a szűrések során olyan módszereket kell alkalmazni, amelyek lehetővé teszik a hatásos komponens azonosítását. A kombinatorikus tárak egyik legfontosabb jellemzője, hogy a teljes keverék szűrése egyetlen folyamatban megvalósítható. Ez teszi ezeket a vegyülettárakat nagyon hasznossá a gyógyszerkutatásban. A teljes kombinatorikus tárak részleges tárai is szintetizálhatók és vizsgálhatók. Némelyikük hatékony szerepet tölthet be a hatásos vegyület azonosításában. [15]
A szilárd hordozóról lehasított tárak szűrése
Ha a kombinatorikus tár szintetizált molekuláit lehasítjuk a szilárd hordozóról, oldható keverék képződik. Az ilyen tárakban több millió különböző vegyület lehet. Amikor ezt a szintetikus módszert kifejlesztették, először lehetetlennek tűnt a molekulák azonosítása és hasznos tulajdonságokkal rendelkező molekulák megtalálása. A probléma megoldására azonban stratégiákat dolgoztak ki, amelyek lehetővé tették a hasznos komponensek azonosítást. Mindezek a stratégiák részleges vegyülettárak szintézisén és tesztelésén alapulnak. A legkorábbi iteratív stratégiát Furka fentebb említett, 1982-ben közjegyző által hitelesített dokumentuma tartalmazza visszakeresés néven. A módszert később Erb et al. is publikálta „Rekurzív dekonvolúció” néven[16]
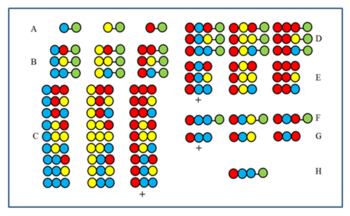
Visszakeresés
A módszert az ábra teszi érthetővé. Egy 27 tagú peptidtárat szintetizálnak három aminosavból. Az első (A) és második (B) ciklus után a mintákat összekeverés előtt félreteszik. A harmadik ciklus (C) termékeit összekeverés előtt lehasítják, majd aktivitásukat tesztelik. Tegyük fel, hogy a + jellel jelölt csoport aktív. Minden tagnak van „vörös” aminosavja az utolsó kapcsolási pozícióban. Következésképpen az aktív tag is rendelkezik a „vörös” aminosavval az utolsó kapcsolási pozicióban. Ezután a „vörös” aminosavat a második ciklus (B) után félretett három mintához kapcsolják, és a D mintákhoz jutnak. A hasítás után a három E minta keletkezik. Ha ezek tesztelése után a +-val jelölt minta az aktív, akkor azt mutatja, hogy a kék aminosav az aktív komponensben a második kapcsolási poziciót foglalja el. Ezután a három A mintához először a kék, majd a piros aminosavat kapcsolnak (F), majd hasítás után újra tesztelik (G). Ha a + komponens aktívnak bizonyul, akkor az aktív komponens aminosav sorrendjét H mutatja.
Pozíciószűrés A pozícióvizsgálatot Furka és munkatársai[17] és tőlük függetlenül és Pinilla és társai[18] vezették be. A módszer altárak sorozatainak szintézisén és tesztelésén alapul, amelyben egy bizonyos szekvencia-pozíciót ugyanaz az aminosav foglalja el. Az ábra a három aminosavból készült teljes három tagú peptidtárát (A) és kilenc altárát (B1-D3) mutatja.
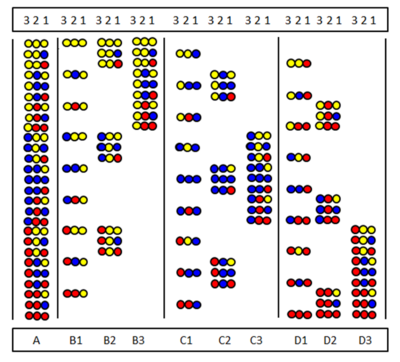
Az altárakban van egy pozíció, amelyet minden komponensben ugyanaz az aminosav foglal el. Egy altár szintézisében a megfelelő kapcsolási lépésben a hordozót nem osztjuk meg, és ezáltal csak egy aminosav kapcsolódik a teljes mintához. Ennek eredményeként egy pozíciót valóban ugyanaz az aminosav foglal el minden komponensben. Például a B2 altárban a 2. pozíciót a „sárga” aminosav foglalja el mind a kilenc komponensben. Ha egy szűrővizsgálat során ez az altár pozitív választ ad, az azt jelenti, hogy az aktív peptid 2-es pozícióját is a „sárga” aminosav foglalja el. Az aminosavszekvencia meghatározható mind a kilenc (esetleg csak néhány néhány) altár tesztelésével.
Kihagyásos peptidtárak A kihagyásos peptidtárakban[19][20] egy bizonyos aminosav hiányzik a keverék összes peptidjéből. Az ábra a teljes tárat és a három kihagyott tárat mutatja. Felül a kihagyott aminosavak láthatók. Ha a kihagyásos könyvtár negatív tesztet ad, a kihagyott aminosav jelen van az aktív komponensben.

Hordozóhoz kötött kombinatorikus tárak szűrése
Ha a kombinatorikus szintézis során képződött peptideket vagy egyéb vegyületeket nem hasítják le a szilárd hordozóról, szemcsék keverét kapják, ahol minden szemcse egyetlen vegyületet tartalmaz. Smith és munkatársai[21] korábban kimutatták, hogy a peptideket megkötött formában is lehet tesztelni. Ezt a megközelítést alkalmazták a peptidtárak szűrésére is. Például a hordozón levő peptidtárat egy fluoreszcens jelzést viselő oldott célfehérjével tesztelik. Kiválasztják azokat a szemcséket, amelyekhez a jelzett fehérje kötődik. Ezután eltávolítják a fehérjét a szemcséről, majd a szemcséhez kötött peptidet szekvenálással azonosítotják. Egy kissé eltérő megközelítést követett Taylor és Morken. [22] Infravörös termográfiát használtak a katalizátorok azonosítására nem peptid természetű szerves vegyülettárakban. A módszer azon a hőn alapul, amely a katalizátort tartalmazó szemcsékben fejlődik, amikor a tárat egy szubsztrát oldatába merítik. Ha a szemcséket infravörös mikroszkóppal vizsgálják, a katalizátort tartalmazó szemcsék fényes foltokként jelennek meg, és elkülöníthetők.
Kódolt kombinatorikus vegyülettárak
A szerves vegyülettárak esetében nem olyan egyszerű a szemcsén levő vegyület szerkezetének meghatározása, mint a peptidek esetében a szekvenálás. Ennek a nehézségnek a megkerülésére dolgoztak ki a vegyülettárak kódolását. A vegyülettár szintézisével párhuzamosan olyan molekulákat kapcsoljanak a szemcsékhez, amelyek kódolják a szemcsékben képződött vegyület szerkezetét. Ohlmeyer és munkatársai közzétettek egy bináris kódolási módszert.[23] 18 jelölőmolekulából álló keverékeket használtak, amelyeket a szemcsékről történő lehasításuk után gázkromatográfia segítségével azonosítottak. Sarkar et al. penténsavamidok királis oligomerjeivel kódolt OBOC-könyvtárakat.[24] Kerr és munkatársai innovatív kódolási módszert vezetett be.[25] A szemcsékhez egy ortogonálisan védett, eltávolítható bifunkciós linkert erősítettek. A linker egyik végét a tár nem természetes építőelemeinek rögzítésére használták, míg a másik végéhez kódolásként aminosav-hármasokat kapcsoltak. Az építőelemek nem természetes aminosavak voltak, és az ezeket kódoló aminosavhármasok sorozata Edman-lebontással meghatározható volt. Hasonló a megközelítést alkalmazott Nikolajev et al. is. [26] 1992-ben Brenner és Lerner DNS-szekvenciákat vezetett be a szilárd hordozó szemcséinek kódolására, amely eddig a legsikeresebb kódolási módszernek bizonyult.[27] Nielsen, Brenner és Janda is a Kerr-megközelítést alkalmazta a DNS-kódolás megvalósításához.[28] Az azóta eltelt időben jelentős előrelépések történtek a DNS-szekvenálás terén. Az un. következő generációs technikák lehetővé teszik nagyszámú, akár több ezer DNS oligomer párhuzamos szekvenálását, ami nagyon fontos a DNS-kódolt tárak szűrésében. Volt egy másik újítás is, amely hozzájárult a DNS-kódolás sikeréhez. 2000-ben Harbury és Halpin kihagyta a szilárd hordozót a DNS által kódolt kombinatorikus tárak szintéziséből, és azt a kódoló DNS oligomerekkel helyettesítette.
A szilárd fázisú megosztásos keveréses szintézis esetén a kombinatorikus vegyülettárak komponenseinek száma nem haladhatja meg a hordozó szemcséinek számát. A szilárd hordozó kihagyásával ez a hátrány megszűnt, és ezzel, gyakorlatilag korlátlan számú új vegyület előállítása vált lehetővé. [29] A dán Nuevolution cég például egy DNS-kódolt tárat szintetizált, amely 40 milliárd komponenst tartalmazott![30] A DNS által kódolt tárak oldhatóak, ami lehetővé teszi a hatékony, a célfehérjéhez történő kötődés alapján történő szűrést. A DNS-kódolt kombinatorikus tárakat nagyon elterjedten alkalmazzák a gyógyszerkutatásban, amit az alábbi példák is mutatnak:
• Kombinatorikus tárak DNS-templáltos szintézise 2001-ben Gartner és munkatársai által.[31]
• Kettős farmakofor DNS-kódolású kombinatorikus tárak, amelyeket 2004-ben publikáltak Mlecco és munkatársai.[32]
• Szekvenciás kódolásos útválasztású szintézis, amelyet 2004-ben tett közzé Halpin és Harbury.[33]
• Egyetlen farmakofór kódolású kombinatorikus tárak, amelyeket 2008-ban vezettek be Manocci és munkatársai.[34]
• DNS-kódolt kombinatorikus tárak, amelyeket yoctoliter-méretű reaktor segítségével hoztak létre, Hansen et al. 2009-ben.[35]
A DNS által kódolt oldható kombinatorikus táraknak vannak hátrányai is. Mindenekelőtt a szilárd hordozó használatából származó előny teljesen elvész. Ezen kívül a DNS-t kódoló láncok poliionos jellege korlátozza a nem vizes oldószerek szintézisben való felhasználását. Ezért érthető, hogy manapság sok kutató foglalkozik azzal, hogy DNS-kompatibilis reakciókat fejlesszen ki a DNS kódolású vegyülettárak szintéziséhez.[36][37][38]
Anyagtudomány
Az anyagtudomány a kombinatorikus kémia technikáit alkalmazta új anyagok felfedezésére, amelynek úttörője J. J. Hanak volt az 1970-es években,[39] but the computer and robotics tools were not available for the method to spread at the time. Work has been continued by several academic groups[40] Számos akadémiai csoport,[41][42][43][44] valamint nagy kutatási és fejlesztési programokkal rendelkező vállalatok (Symyx Technologies, GE, Dow Chemical stb.) is bekapcsolódtak. A technikát széles körben alkalmazták katalízis[45] és a bevonatokban kutatásában,[46] [61] valamint az elektronikában[47] és sok más területen.[48] A megfelelő informatikai eszközök alkalmazása kritikus fontosságú a hatalmas mennyiségű előállított adat kezeléséhez, adminisztrálásához és tárolásához.[49]
Jegyzetek[szerkesztés]
- ↑ (2017) „Customizable Generation of Synthetically Accessible, Local Chemical Subspaces”. J. Chem. Inf. Model. 57 (3), 454–467. o. DOI:10.1021/acs.jcim.6b00648. PMID 28234470.
- ↑ Furka Á. Tanulmány, gyógyászatilag hasznosítható peptidek szisztematikus felkutatásának lehetőségéről (and Study on the possibility of systematic searching for pharmaceutically useful peptides https://mersz.hu/mod/object.php?objazonosito=matud202006_f42772_i2
- ↑ Furka Á (2002). Combinatorial Chemistry 20 years on… Drug DiscovToday 7; 1-4. doi:10.1016/S1359-6446(02)00001-6
- ↑ Furka Á, Sebestyén F, Asgedom M, Dibó G. Cornucopia of peptides by synthesis. In Highlights of Modern Biochemistry, Proceedings of the 14th International Congress of Biochemistry. VSP.Utrecht.1988; 5; p. 47.
- ↑ Á. Furka, F. Sebestyen, M. Asgedom, G. Dibo, General method for rapid synthesis of multicomponent peptide mixtures. Int. J. Peptide Protein Res., 1991, 37, 487-493.
- ↑ Merrifield RB, 1963 J. Am. Chem. Soc. 85, 2149.
- ↑ (1990. július 27.) „Searching for peptide ligands with an epitope library”. Science 249 (4967), 386–390. o, Kiadó: American Association for the Advancement of Science (AAAS). DOI:10.1126/science.1696028. ISSN 0036-8075. PMID 1696028.
- ↑ (1990. augusztus 1.) „Peptides on phage: a vast library of peptides for identifying ligands.”. Proceedings of the National Academy of Sciences 87 (16), 6378–6382. o. DOI:10.1073/pnas.87.16.6378. ISSN 0027-8424. PMID 2201029.
- ↑ J. J. Devlin, L. C. Panganiban and P. E. Devlin Science 1990, 249, 404.
- ↑ Fodor SP, Read JL, Pirrung MC, Stryer L, Lu AT, Solas D, 1991. Light-directed, spatially addressable parallel chemical synthesis. Science 251, 767-73.
- ↑ H. M. Geysen, R. H. Meloen, S. J. Barteling Proc. Natl. Acad. Sci. USA 1984, 81, 3998.
- ↑ E. J. Moran, S. Sarshar, J. F. Cargill, M. Shahbaz, A Lio, A. M. M. Mjalli, R. W. Armstrong J. Am. Chem. Soc. 1995, 117, 10787.
- ↑ K. C. Nicolaou, X –Y. Xiao, Z. Parandoosh, A. Senyei, M. P. Nova Angew. Chem. Int. Ed. Engl. 1995, 36, 2289.
- ↑ Á. Furka, J. W. Christensen, E. Healy, H. R. Tanner, H. Saneii J. Comb. Chem. 2000, 2, 220.
- ↑ A. Furka Sub-Library Composition of Peptide Libraries. Potential Application in Screening. Drug Development Research 33, 90-97 (1994).
- ↑ Erb E, Janda KD, Brenner S (1994) Recursive deconvolution of combinatorial chemical libraries Proc. Natl Acad Sci.USA 91; 11422-11426.
- ↑ Furka Á, Sebestyén F, WC 93/24517, 1993.
- ↑ Pinilla C, Appel JR, Blanc P, Houghten RA (1993) Rapid identification of high affinity peptide ligands using positional scanning synthetic peptide combinatorial libraries. BioTechniques 13(6); 901-5.
- ↑ Carell TE, Winter A, Rebek J Jr. (1994) A Novel Procedure for the Synthesis of Libraries Containing Small Organic Molecules, Angew Chem Int Ed Engl 33; 2059-2061.
- ↑ Câmpian E, Peterson M, Saneii HH, Furka Á, (1998) Deconvolution by omission libraries, Bioorg &[ Med Chem Letters 8; 2357-2362.
- ↑ J. A. Smith J. G. R. Hurrel, S. J. Leach A novel method for delineating antigenic determinants: peptide synthesis and radioimmunoassay using the same solid support. Immunochemistry 1977, 14, 565.
- ↑ S. J. Taylor, J. P. Morken Thermographic Selection of Effective Catalysts from an Encoded Polymer-Bound Library Science 1998, 280, 267.
- ↑ Ohlmeyer MHJ, Swanson RN, Dillard LW, Reader JC, Asouline G, Kobayashi R, Wigler M, Still WC (1993) Complex synthetic chemical libraries indexed with molecular tags, Proc Natl Acad Sci USA 90; 10922-10926.
- ↑ Sarkar M, Pascal BD, Steckler C, Aquino C., Micalizio GC, Kodadek T, Chalmers MJ (1993) Decoding Split and Pool Combinatorial Libraries with Electron Transfer Dissociation Tandem Mass Spectrometry, J Am Soc Mass Spectrom 24(7): 1026-36.
- ↑ Kerr JM, Banville SC, Zuckermann RN (1993) Encoded Combinatorial Peptide Libraries Containing Non-Natural Amino Acids, J Am Chem. Soc 115; 2529-2531.
- ↑ Nikolaiev V, Stierandová A, Krchnák V, Seligmann B, Lam KS, Salmon SE, Lebl M, (1993) Peptide-encoding for structure determination of nonsequenceable polymers within libraries synthesized and tested on solid-phase supports, Pept Res. 6(3):161-70.
- ↑ Brenner S, Lerner RA. (1992) Encoded combinatorial chemistry. Proc Natl Acad Sci USA 89; 5381–5383.
- ↑ Nielsen J, Brenner S, Janda KD. (1993) Synthetic methods for the implementation of encoded combinatorial chemistry. Journal of the American Chemical Society, 115 (21); 9812–9813.
- ↑ Harbury DR, Halpin DR (2000) WO 00/23458.
- ↑ B. Halford How DNA-encoded libraries are revolutionizing drug discovery. C&EN 2017, 95, Issue 25.
- ↑ Gartner ZJ, Tse BN, Grubina RB, Doyon JB, Snyder TM, Liu DR (2004) DNA-Templated Organic Synthesis and Selection of a Library of Macrocycles, Science 305; 1601-1605.
- ↑ Melkko S, Scheuermann J, Dumelin CE, Neri D (2004) Encoded self-assembling chemical libraries Nat Biotechnol 22; 568-574.
- ↑ Halpin DR, Harbury PB (2004) DNA Display I. Sequence-Encoded Routing of DNA Populations, PLoS Biology 2; 1015-102.
- ↑ Mannocci L, Zhang Y, Scheuermann J, Leimbacher M, De Bellis G, Rizzi E, Dumelin C, Melkko S, and Neri N (2008) High-throughput sequencing allows the identification of binding molecules isolated from DNA-encoded chemical libraries, Proc Natl Acad Sci USA 105;17670–17675.
- ↑ Hansen MH, Blakskjær P, Petersen LK, Hansen TH, Højfeldt JW, Gothelf KV, HansenNJV (2009) A Yoctoliter-Scale DNA Reactor for Small-Molecule Evolution (2009) J Am Chem Soc 131; 1322-1327.
- ↑ Luk KC, Satz AL (2014) DNA‐Compatible Chemistry in: Goodnow Jr. RA Editor A Handbook for DNA‐Encoded Chemistry: Theory and Applications for Exploring Chemical Space and Drug Discovery, Wiley, pp 67-98.
- ↑ Satz AL, Cai J, Chen Y,§, Goodnow R, Felix Gruber F, Kowalczyk A, Petersen A, Naderi-Oboodi G, Orzechowski L, Strebel Q (2015) DNA Compatible Multistep Synthesis and Applications to DNA Encoded Libraries Bioconjugate Chem 26; 1623−1632.
- ↑ Li Y, Gabriele E, Samain F, Favalli N, Sladojevich F, Scheuermann J, Neri D (2016) Optimized reaction conditions for amide bond formation in DNA-encoded combinatorial libraries, ACS Comb Sci 18(8); 438–443.
- ↑ J.J. Hanak, J. Mater. Sci, 1970, 5, 964-971
- ↑ [55] de munkásságára csak a megosztásos keveréses kombinatorikus szintézismódszer publikálása után figyeltek fel. A követők jeles képviselője a kilencvenes években P.G. Schultz volt. <ref>X. -D. Xiang et al. "A Combinatorial Approach to Materials Discovery" Science 268 (1995) 1738
- ↑ Combinatorial methods for development of sensing materials, Springer, 2009. ISBN 978-0-387-73712-6
- ↑ V. M. Mirsky, V. Kulikov, Q. Hao, O. S. Wolfbeis. Multiparameter High Throughput Characterization of Combinatorial Chemical Microarrays of Chemosensitive Polymers. Macromolec. Rap. Comm., 2004, 25, 253-258
- ↑ H. Koinuma et al. "Combinatorial solid state materials science and technology" Sci. Technol. Adv. Mater. 1 (2000) 1 free download
- ↑ Andrei Ionut Mardare et al. "Combinatorial solid state materials science and technology" Sci. Technol. Adv. Mater. 9 (2008) 035009 free download
- ↑ Applied Catalysis A, Volume 254, Issue 1, Pages 1-170 (10 November 2003)
- ↑ J. N. Cawse et al., Progress in Organic Coatings, Volume 47, Issue 2, August 2003, Pages 128-135
- ↑ Combinatorial Methods for High-Throughput Materials Science, MRS Proceedings Volume 1024E, Fall 2007
- ↑ Combinatorial and Artificial Intelligence Methods in Materials Science II, MRS Proceedings Volume 804, Fall 2004
- ↑ QSAR and Combinatorial Science, 24, Number 1 (February 2005)
