Vas(II)-bromid
| vas(II)-bromid | |||
 vas(II)-bromid | |||
| IUPAC-név | vas(II)-bromid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7789-46-0 | ||
| PubChem | 659170 | ||
| ChemSpider | 74218 | ||
| |||
| |||
| InChIKey | GYCHYNMREWYSKH-UHFFFAOYSA-L | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | FeBr2 | ||
| Moláris tömeg | 215,65 g mol−1 | ||
| Megjelenés | sárgásbarna, szilárd anyag | ||
| Sűrűség | 4,63 g cm−3, szilárd | ||
| Olvadáspont | 684 °C ((anhidrát) 27 °C (hexahidrát)) | ||
| Forráspont | 934 °C | ||
| Oldhatóság (vízben) | 117 g / 100 ml | ||
| Oldhatóság (más oldószerek) | THF, metanol, etanol | ||
| Mágneses szuszceptibilitás | +13,600·10−6 cm³/mol | ||
| Kristályszerkezet | |||
| Kristályszerkezet | romboéderes, hP3 | ||
| Tércsoport | P-3m1, No. 164 | ||
| Koordinációs geometria |
oktaéderes | ||
| Veszélyek | |||
| Főbb veszélyek | nincs | ||
| R mondatok | R20 R36/37/38 | ||
| S mondatok | S26 S36 | ||
| Rokon vegyületek | |||
| Azonos kation | vas(II)-klorid | ||
| Azonos anion | vas(III)-bromid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A vas(II)-bromid szervetlen vegyület, képlete FeBr2. A vízmentes vegyület sárga vagy barnás színű, paramágneses szilárd anyag. Több hidrátformája is ismert, ezek halvány színű szilárd vegyületek. Más vasvegyületek laboratóriumi előállításának szokásos kiindulási anyaga, de ipari alkalmazása nincs.
Szerkezete[szerkesztés]
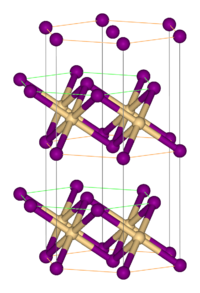
Más fém-halogenidekhez hasonlóan polimer szerkezettel rendelkezik, melyben az izolált fémcentrumokat halogenid kapcsolják össze. CdI2 rácsban kristályosodik, melyben a bromidionok szorosan illeszkedő rétegei közötti oktaéderes lyukakban helyezkednek el a Fe(II) ionok.[1] Ez némileg eltér a FeCl2 rácsától, mely CdCl2 szerkezetű.
Előállítása és reakciói[szerkesztés]
Vaspor és tömény hidrogén-bromid metanolos oldatának reakciójával állítják elő, melynek során [Fe(MeOH)6]Br2 metanol szolvát és hidrogéngáz keletkezik. A metanolkomplexet vákuum alatt melegítve kapjuk a tiszta FeBr2-ot.[2] Vas és elemi bróm reakciójával nem állítható elő, mivel ilyenkor vas(III)-bromid keletkezik.[forrás?]
2 ekvivalens (C2H5)4NBr-rel reagálva [(C2H5)4N]2FeBr4 keletkezik belőle.[3]
Bromiddal és brómmal reagáltatva intenzív színű [FeBr3Br9]−-et képez.[4]
Mint minden vas(II) vegyület, a FeBr2 is gyenge redukálószer.[forrás?]
Mágnesessége[szerkesztés]
4,2 K-en erősen metamágneses, a metamágneses vegyületek prototípusaként sokat tanulmányozták.[5][6]
Hivatkozások[szerkesztés]
- ↑ Haberecht, J.; Borrmann, H.; Kniep, R. "Refinement of the Crystal Structure of Iron Dibromide, FeBr2" Zeitschrift für Kristallographie - New Crystal Structures 2001, vol. 216, p. 510. doi:10.1524/ncrs.2001.216.14.544
- ↑ G. Winter, "Iron(II) Halides" "Inorganic Syntheses" 1973, volume 14, pages 101-104. doi:10.1002/9780470132456.ch20
- ↑ N. S. Gill, F.. B. Taylor Inorganic Syntheses 1967, volume 9, page 136-142. doi:10.1002/9780470132401.ch37
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ↑ (1959. január 15.) „Neutron Diffraction Investigations of the Magnetic Ordering in FeBr2, CoBr2, FeCl2, and CoCl2”. Physical Review 113 (2), 497–507. o. DOI:10.1103/PhysRev.113.497.
- ↑ (1967. december 10.) „Metamagnetic Phase Transitions and Hysteresis in FeCl2”. Physical Review 164 (2), 866–878. o. DOI:10.1103/PhysRev.164.866.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az Iron(II) bromide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
