Tüdőrák
| Tüdőrák | |
 | |
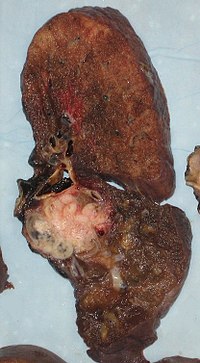
| Keresztmetszeti kép egy emberi tüdőről. A lebeny felső szegmensében látható fehér elváltozás maga a daganat. A tüdő állományában antrakózis látható. | |
| Osztályozás | |
| BNO-10 | C33.-C34. |
| BNO-9 | 162 |
| Főbb tünetek |
|
| Adatbázisok | |
| OMIM | |
| DiseasesDB | 7616 |
| MedlinePlus | 007194 |
| eMedicine | med/1333 |
| MeSH ID | D002283 |
A Wikimédia Commons tartalmaz Tüdőrák témájú médiaállományokat. | |
A tüdőrák, vagy közismert nevén tüdőkarcinóma a tüdő szövetéből kiinduló korlátlan osztódási képességgel bíró kóros sejtszaporulat, rosszindulatú daganat.[1][2] A folyamat áttét (metasztázis) képzéséhez is vezethet, amely alatt az abnormális tüdőszövetnek más szervekben való megjelenését és burjánzását lehet érteni.[3] A tüdőrákok többsége a tüdő epitheliális szövetéből, azaz hámszövetéből származik. A betegség évente 1,3 millió ember halálát okozza világszerte.[4] A tüdőrák leggyakoribb tünete a rövid, nehézkes légzés, a gyakori köhögés (néha vérköpéssel kísérve) illetve a testsúly csökkenése, valamint a mellkasi fájdalom.[5][6]
A tüdő daganatos elváltozásai között megkülönböztetnek kissejtes és nem-kissejtes formákat.[7] Az elkülönítés fontos, mivel ez határozza meg a később alkalmazandó terápiát. A nem-kissejtes (NSCLC) elváltozás műtéttel kezelhető, viszont kevésbé reagál a kemo- és sugárterápiára.[8] A kissejtes (SCLC) változatról mindezek ellenkezője mondható el: nem operálható, viszont a kemoterápiára illetve sugárterápiára érzékeny.[8]
A tüdőrákot indukáló tényezők között az első helyet a dohányfüst foglalja el.[1] Az esetek túlnyomó többségében (85%) a tüdőrák a hosszú időn át végzett dohányzás miatt alakul ki. A nem dohányzók mindössze 10-15%-át teszik ki a tüdőrákos betegeknek,.[9] esetükben genetikai[10][11] illetve egyéb környezeti tényezők, mint például radon gáz,[12] azbeszttel való érintkezés,[13] levegőszennyezés[14][15][16] és a passzív dohányzás[17][18] játszanak döntő szerepet.[19][20][13][21] A veszélyeket jelentő faktorok kiiktatásával, beleértve a dohányzást, illetve a légszennyezést lehet a megelőzés elsődleges lépéseit megtenni.[22]
A rákos elváltozás sokszor észrevehető egyszerű röntgenképen, illetve könnyen azonosítható CT-vel.[23][24] A pozitív diagnózist minden esetben a biopsziát követő szövettani eredmény mondhatja ki. A kezelést a szövettani besoroláson túl a daganat stádiuma és a beteg fizikai állapota határozza meg. A beavatkozás lehet sebészi, (főleg a nem kis sejtes tüdő karcinóma esetében), illetve az aprósejtes tüdő karcinóma esetében a kemoterápia, a sugárkezelés, vagy mindezek kombinációja.[25]
2012-ben a világon mintegy 1 800 000 embert érintett tüdőrákos megbetegedés és ebben az évben 1 600 000 ember hunyt el tüdőrák következtében.[26] Ez alapján a tüdőrák a leggyakoribb halálos kimenetelű rákos megbetegedés a férfiaknál, míg a nők esetében a második leggyakoribb halálozási ok a mellrákot követően.[27] A leggyakrabban 70 éves korban diagnosztizálják e betegséget. Az Amerikai Egyesült Államokban diagnosztizált tüdőrákos betegek közül összességében csak 17,4 százaléka a betegeknek élt még öt évvel a betegség megállapítását követően.[28] A tüdőrák következményei a fejlődő világ országaiban jóval súlyosabbak.[29] A kezelést követő 5 éves túlélés esélye átlagosan 14%.[5][30]
Története[szerkesztés]
A tüdőrák a nem gyakori betegségek körébe tartozott a dohányzás elterjedését megelőzően, ezért 1761-ig nem is tekintették különálló betegségnek.[31] A tüdőrák különböző fajtáit 1810-ben írták le először.[32] 1878-ig a tüdő daganatos elváltozásai a malignus daganatok közel 1%-át tették ki, de ez az érték 1900-ra 10-15%-ra nőtt.[33] 1912-ig mindössze 374 esetet diagnosztizáltak a patológusok világszerte.[34] A dohányzás és a tüdődaganat kialakulása közötti összefüggésre először 1929-ben figyelt fel Fritz Lickint német orvos.[33] Az első hivatalos tanulmány, amely bizonyította a rák és a dohányzás közötti összefüggést 1950-ben jelent meg brit orvosok tollából.[35] 1964-ben az amerikai sebészek már javasolták a dohányosoknak a dohányzásról való leszokást egészségügyi okok miatt.[36]
Az első sikeres tüdőeltávolítást 1933-ban végezték.[37] Palliatív sugárterápiát 1940-óta alkalmaznak,[38] míg a beavatkozás, mint primer kezelési mód pusztán 1950 után terjedt el.
A kissejtes tüdőrák kezelésére irányuló erőfeszítések (sebészi beavatkozás és sugárterápia) az 1960-as évekig eredménytelenek voltak.[39][40] Az első sikeres műtétre 1970-ig kellett várni.[41]
Epidemiológia[szerkesztés]

Incidenciáját és mortalitását tekintve a tüdőrák a legelterjedtebb daganatféleség a világon (1,35 millió új eset évente 1,18 millió halálos áldozattal). A statisztikák szerint a tüdőrák 50 év felett, korábban vagy jelenleg is aktívan dohányzó személyekben alakul ki a leggyakrabban. A tüdőrák a második leggyakoribb daganatos elváltozás a nyugati országokban és a legelső helyet foglalja el a halállal végződő daganatos megbetegedések között. Habár a nyugati országokban a halálozás aránya csökken a férfi lakosság körében ez nem mondható el a női populációról, köszönhetően a dohányzás egyre nagyobb elterjedésének e csoporton belül.[42] Ez többek között a dohánygyárak sikeres kampányának is köszönhető, akik az 1970-es évek óta előszeretettel célozzák meg a női fogyasztói réteget (light és hosszú cigaretták).
Nem minden tüdőrák alakul ki dohányzás talaján, de a passzív dohányzás, mint kiváltó tényező egyre inkább előtérbe kerül, ami megelőző intézkedések meghozatalára serkenti a kormányokat a nem dohányzók védelmében. A gépkocsik, gyárak és erőművek által kibocsátott szennyeződés szintén jelentős előmozdító tényezőnek bizonyul.[14][16][43]
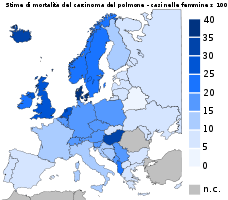
Kelet-Európa rendelkezik a legnagyobb mortalitási indexszel a férfi tüdőrákosok körében, míg a legtöbb tüdőrákban szenvedő nő Nyugat Európában és az Egyesült Államokban halálozik el. Az előrejelzések szerint a közeljövőben a tüdőrákban meghaltak száma növekedni fog a fejlődő országokban, mint Kína[44] és India.[45]
A rákos megbetegedések jól korrelálnak a napsütéses órák számával és az UVB sugárzás mértékével. Feltételezhető, hogy a napfény hatására a bőrben keletkező D-vitamin protektív hatást fejt ki.[46]
Az 1950-es évektől kezdve az adenokarcinóma vált a leggyakoribb tüdődaganattá.[47] Ez valószínűleg a cigarettán lévő filterek bevezetésének köszönhető. A filter meggátolja a nagyobb részecskék átjutását, és így azok lerakódását a nagyobb bronchusokban. Sajnálatos módon azonban a dohányzónak nagyobb, mélyebb slukkot kell szívnia, hogy azonos mennyiségű nikotint juttasson a szervezetébe, így viszont elősegíti a kisebb szemcsék lerakódását a kisebb bronchusokba, ahonnan az adenokarcinóma származik.[48]
-
A tüdőrák incidenciája Európa férfi lakossága körében (2006)
-
A tüdőrák incidenciája Európa női lakossága körében (2006)
-
A tüdőrák mortalitása Európa férfi lakossága körében (2006)
-
A tüdőrák mortalitása Európa női lakossága körében (2006)
|
Klasszifikáció[szerkesztés]
Primer tüdődaganatok[szerkesztés]
A tüdőrákok többsége malignus karcinóma, amelyek a tüdő epithel szöveteiből indulnak ki. Méretük és mikroszkópos megjelenési mintázatuk alapján a patológusok két csoportot különítenek el: nem-kissejtes (80,4%) és kissejtes (16,8%) változatokat.[30] A szövettani besorolás fontos szerepet tölt be a terápia, illetve a betegség kimenetele szempontjából.
| Szövettani besorolás | Gyakoriság (%) |
|---|---|
| nem-kissejtes forma | 80.4 |
| Kissejtes forma | 16.8 |
| Carcinoid[49] | 0.8 |
| Szarkóma[50] | 0.1 |
| Nem azonosított | 1.9 |
Nem-kissejtes karcinóma (NSCLC)[szerkesztés]
A nem-kissejtes (Non-small cell lung carcinoma) elváltozásokat egy csoportba sorolják, mivel kezelésük és kimenetelük hasonló. Ide három daganatos elváltozást sorolnak: a laphámrákot (laphámból kiinduló, planocellularis carcinomát), a nagysejtes illetve az adenokarcinómát. A tüdőrákok 33,3%-át[30] kitevő laphámrák az esetek többségében centrális elhelyezkedésű és a fő bronchusból indul ki. A daganat üregképzésre és nekrózisra hajlamos. Jól differenciált formái a többi tüdőrákhoz képest viszonylag lassabb növekedést mutatnak.[8] A tüdő daganatainak 29,4%-a adenokarcinóma.[30] Az elváltozás általában a tüdő perifériás részéből kiinduló növedék. Az adenocarcinómák többsége erős asszociációt mutat a dohányzással, habár ez a változat a nem dohányosok körében előforduló leggyakoribb tüdőrák.[51]
| Altípus | Nem-kissejtes tumorok gyakorisága (%) | ||
|---|---|---|---|
| Dohányzók | Nem dohányzók | ||
| Laphámrák | 42 | 33 | |
| Adenocarcinóma | Adenocarcinóma (más módon nem specifikált) | 39 | 35 |
| Bronchioloalveoláris carcinóma | 4 | 10 | |
| Carcinoid | 7 | 16 | |
| Egyéb | 8 | 6 | |
Kissejtes tüdőrák (SCLC)[szerkesztés]

A kissejtes tüdőrák (Small cell carcinoma) egy kevésbé gyakori forma. A primer és secunder hörgőkből eredő elváltozás gyorsan növekszik és viszonylag nagyra nő.[24] A tüdő daganatai közül ez mutatja a legnagyobb összefüggést a dohányzással.[53] Sebészileg nem eltávolítható, kemo- illetve sugárterápiára érzékeny, agresszív daganat. Tüneteket akkor okoz, amikor a légutakat komprimálja. A felfedezés időpontjában rendszerint már távoli áttéteket ad, ez a forma rendelkezik a legrosszabb prognózissal.
Egyéb daganatok[szerkesztés]
A gyermekek leggyakoribb primer tüdődaganata a blastoma és a carcinoid.[54]
Szekunder daganatok[szerkesztés]
Szekunder tüdőrákok alatt a tüdőbe adott daganatos áttéteket értjük. Gyermekekben a legtöbb tüdőrák áttét következménye.[54] A tüdő daganatainak többsége haematogen úton a mellékvesébe, a májba, az agyba és a csontokba ad áttétet. Per continuitatem a pleurára, a bordákra és a sternumra terjed.[55]
Jelek és tünetek[szerkesztés]
Tünetek, amelyek felvethetik a tüdőrák gyanúját a következők:[56]
- dyspnoe (nehézlégzés)
- haemoptyzis (vérköpés)
- krónikus köhögés, vagy a köhögés mintázatának megváltozása
- mellkasi fájdalom
- cachexia (senyvedés)
- dysphagia (fájdalmas nyelés)
Amennyiben a daganat a légutakba befelé nő, elzárhatja azokat, légzési nehézséget és más tüneteket okozva. Az elzáródás mögött felhalmozódó és pangó folyadék felülfertőződhet és pneumóniát (tüdőgyulladás) eredményezhet. A sérülékeny daganatok mechanikai behatásra megrepedhetnek, és a belőlük elfolyó vér komplikációkat válthat ki (vérköpés, haemothorax, halál). A tumor továbbá összenyomhatja a mediasztinumban futó felső üres visszeret (vena cava superior) is, vena cava superior szindrómát okozva.[57]
A tumor típusától függően paraneopláziás szindróma tünetei is jelentkezhetnek a betegen, amely szintén felvetheti a tüdőrák gondolatát.[58] A tüdőcsúcsban elhelyezkedő daganatok méretüknél fogva komprimálhatják a szimpatikus idegrendszer idegeit.[59]
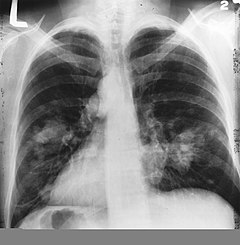
A tüdőrákban szenvedők 10%-nak nincsenek tüneteik.[5] Ebben az esetben a daganatot általában rutinvizsgálat során szokták felfedezni (tüdőröntgen során).
Kiváltó okok[szerkesztés]
A tüdőrák (és a legtöbb rák) kialakulását, megjelenését több tényező indukálhatja, mint például carcinogének (ideértve a dohányfüstben lévő 4000 káros anyagot), virális infekció és ionizáló sugárzás. Az előbb felsorolt tényezőknek kitett szövetben (tüdőrák esetében a bronchus epitheliuma) a sejtek DNS-e károsodik. Minél nagyobb a károsodás, és minél több sejt szenved elváltozást, annál nagyobb a daganat kialakulásának esélye.[8]
A dohányzás[szerkesztés]

A dohányfüst a tüdőrákot indukáló tényezők legfontosabbika.[60] A fejlett világban a halálos tüdődaganatok 90%-át a dohányzás okozza.[61] Az Egyesült Államokban a dohányzás okolható a tüdőrákok 87%-áért (90% férfiakban, 85% nőknél).[62] A dohányzó férfiakban a tüdőrák kialakulásának kockázata 17,2%, míg a dohányzó nőkben ez az érték 11,6%. A nem dohányzó populációban a tüdőrák kialakulásának kockázata jóval alacsonyabb: férfiakban 1,3% nőknél 1,4%.[63] A dohányfüst több mint 4000 káros anyagot tartalmaz, ezek közül több mint 60 bizonyítottan[64] rákkeltő. Ilyen például a nitrózamin, a benzopirén és a radioaktív radon gáz. Mindemellett a dohányban lévő nikotin csökkenti az immunrendszer válaszát a daganatos sejtburjánzásra.[65]
Minél tovább dohányzik valaki, annál nagyobb eséllyel lesz tüdőrákos.[66] Tény, hogy a nem dohányzók jobb prognózisra (hosszabb túlélésre) számíthatnak, mint a dohányzók, illetve azok, akik a diagnózis felállításakor is dohányoznak.[67][68]
A passzív dohányzás a tüdőrák kialakulásának egyik jelentős oka nem dohányzókban. Amerikai,[69] brit,[70] európai[71] és ausztráliai[72] tanulmányok alátámasztják, hogy a passzív dohányzás növeli a rák kialakulásának kockázatát. A legújabb kutatások igazolják azt a feltételezést is, hogy a passzív dohányzás kártékonyabb az aktív dohányzásnál.[73]
Radon gáz[szerkesztés]
A radon egy színtelen, szagtalan gáz, amely a radioaktív rádium bomlása során szabadul fel. A radon a második helyet foglalja el a tüdőrákot indukáló tényezők között.[12] A radonszint nagy változatosságot mutat, földrajzi helyzettől függően változik.
Azbeszt[szerkesztés]
Azbesztexpozíció széles körű tüdőbetegségeket okozhat, köztük tüdőrákot is. A szervezetben lerakódó azbeszt és a dohányzás között szignifikáns kapcsolat van.[13] Dohányzó, azbeszttel fertőzött embernek 55-ször nagyobb esélye van arra, hogy tüdőrákban fog megbetegedni. Mindemellett az azbeszt a pleura (mellhártya) malignus elváltozásaiért is felelős.
Vírusok[szerkesztés]
Bizonyított, hogy virális infekciók indukálhatják a tüdő sejtjeinek malignus transzformációját állatok esetében,[74][75] és újabb kutatások szerint hasonló folyamatok emberekben is lejátszódhatnak. Feltételezett patogének: humán papillómavírus,[76] JC vírus,[77] SV40, BK, citomegalovírus.[78] Ezen kórokozók befolyásolhatják a sejtciklust és gátolhatják a sejtek apoptózisát.
Pathogenezis[szerkesztés]
Hasonlóan más rákos elváltozásokhoz a tüdőrák is onkogének aktivációjával, illetve tumor szupresszor gének inaktivációjával kezdődik.[79] Az onkogének olyan humán gének, amelyekről feltételezik, hogy túlzott kifejeződésükkel képesek beindítani a rákos elfajulásokat. A proto-onkogének rákkeltő hatásokra képesek onkogénekké differenciálódni.[80] A K-RAS prot-onkogénben végbement mutáció felelős a tüdő adenocarcinómáinak 10-30%-ért.[81][82] Az epidermális növekedési receptor (EGFR) fiziológiás körülmények között angiogenezisért és a sejtek apoptózisáért is felelős.[81] Mutációja gyakori a kissejtes tüdőrákokban, így lehetőséget biztosít EGFR agonista gyógyszerek terápiás alkalmazására. Kromoszóma mutációk hajlamossá tesznek a heterozigóta jelleg elvesztésére, és így a tumor szupresszor gének inaktiválódására is egyben. A kromoszómák károsodása, mint pl a 3p, 5q, 13q, és 17p szintén gyakoriak a kis-sejtes tüdőrákokban. A p53 nevű fehérjét kódoló gén mutációja a 17-es kromoszómán a tüdő daganatos elváltozásainak 60-75%-ban előfordul.[83] További, gyakran előforduló génmutációk: c-MET, NKX2-1, LKB-1, PIK3CA és BRAF.[81]
Diagnózis[szerkesztés]

Amennyiben a tüdőrák lehetősége felmerül egy betegnél, az első diagnosztikus lépés a mellkasröntgen. Pozitív esetben a daganat kontúrjai észrevehetőek. Amennyiben daganatos elváltozás nem észlelhető, de a gyanú erősen megalapozott, bronchoscópia és/vagy CT vizsgálat biztosíthatja a szükséges információkat. Bronchoscópia vagy CT biopsziával kombinálva lehetővé teszi a daganat szövettani besorolását.[5]
Tüdőrákhoz hasonló röntgenképet adhatnak a tüdő egyéb nem daganatos elváltozásai, mint például tuberkulózis, sarcaidozis vagy mediasztinális lymphadeonpathia.[8]
Megelőzés[szerkesztés]
A megelőzés a legköltséghatékonyabb eljárás a tüdőrák leküzdésére. Habár a legtöbb országban a rákkeltő ipari és mezőgazdasági vegyszereket betiltották, a dohányzás továbbra is világszerte elterjedt. A dohányzás elterjedésének visszaszorítása és a már dohányzók leszoktatása a megelőzés elsődleges eszköze.[84] A megelőzési programok célkorosztálya a fiatalság. Az Egyesült Államokban a szövetségi államok maguk finanszírozzák prevenciós programjaikat, amelyeknek döntő bevétele a cigaretta jövedéki adójából származik (habár az ebből befolyt összegnek 15%-át sem költik erre a célra[85]).
A passzív dohányzás megelőzésére tett kísérletek is egyre inkább elterjednek. Ennek értelmében tilos a dohányzás középületekben: Kaliforniában (1998), Írországban (2004), Olaszországban (2005), Norvégiában (2005), Skóciában (2006), Angliában (2007), Franciaországban (2008). Új-Zéland kormánya betiltotta a köztereken való dohányzást 2004-ben. 2005 óta Bhutánban tilos a dohányzás minden formája.[86]
Egy 2008-as, 75000 közép és időskorú emberen végzett tanulmány szerint a hosszú távú vitaminszedés nem csökkenti a tüdőrák kialakulásának kockázatát, sőt, a túlzott mennyiségű E-vitamin fogyasztása feltehetően növeli az esélyt a tumor kialakulására.[87]
A fiatalkorúak védelmében a WHO felszólította a kormányokat a dohányzás teljes betiltására világszerte.
Kezelés[szerkesztés]
A tüdőrák kezelését meghatározza: a daganat szövettani jellege, a daganat kiterjedése (státusz, grádus) illetve a beteg fizikai állapota. A legelterjedtebb kezelések közé a sebészi beavatkozás, továbbá a sugár- és kemoterápia tartozik.[5][88]
Sebészi beavatkozás[szerkesztés]
Amennyiben a vizsgálatok igazolták a rák meglétét, a betegen CT vizsgálatot, vagy PET-CT végeznek, hogy megállapítsák a kóros szövet pontos helyzetét illetve annak rezekálhatóságát. Amennyiben a tumor szétterjedt, sebészi eltávolíthatósága és így a műtét is kérdésessé válik. IV-es stádiumú daganat inoperábilis. Ezen betegek sebészi kezeléssel nem gyógyíthatóak.
Vérvizsgálatok és spirometria elvégzése is szükséges a beteg fizikális állapotának felmérésére. Amennyiben a beteg légzési értékei nem megfelelőek (gyakran COPD miatt), a műtéti beavatkozás ellenjavallt.
A beavatkozás közbeni halálozási arány 4,4% amelynek mértékét döntően a páciens légzési funkciói határozzák meg.[89] Sebészi beavatkozást döntően abban az esetben alkalmaznak, ha a daganat nem-kissejtes, csak az egyik tüdőt érinti és stádiuma maximum III fokú.
A műtét során eltávolíthatják egy lebeny bizonyos részét/részeit, a teljes lebenyt (lobectomia) vagy az egyik tüdőt (pulmonectomia).
Kemoterápia[szerkesztés]
A kissejtes tüdőrák sebészileg nem kezelhető, kizárólag kemo- illetve sugárterápiával kísérelhető meg a gyógyítás. Kemoterápiát alkalmaznak metasztatikus nem-kissejtes tüdődaganatok esetében is.
Adjuváns kemoterápia[szerkesztés]
Az adjuváns kemoterápiás kezelést sebészi beavatkozást követően alkalmaznak, hogy a terápia sikeres kimenetelét növeljék. A műtét alatt mintákat vesznek a környező nyirokcsomókból (sentinel nyirokcsomók). Amennyiben a szövettan igazolja a daganatos sejtek meglétét (II-III as stádium) megkezdik az adjuváns terápia alkalmazását. Az adjuváns kezelés 15%-kal is növeli a túlélés esélyét.[90][91]
Sugárterápia[szerkesztés]
A sugárkezelést gyakran alkalmazzák kemoterápiás szerekkel kombináltan, illetve azon nem kissejtes daganatok esetén, amelyeket nem lehet sebészileg eltávolítani. A beavatkozás ezen formáját radikális sugárterápiának nevezik, mivel rövid idő alatt nagy dózist kap a beteg.[92][93] A potenciálisan gyógyítható kissejtes elváltozásokat szintén ezzel a módszerrel kezelik.[94] A sugárterápia alkalmazása, mint adjuváns beavatkozás nem-kissejtes carcinóma műtéti eltávolítását követően nem elterjedt és vitatott. Előnyök – amennyiben származnak a beavatkozásból – azon személyekben észlelhetőek, akiknél lymphogén áttétet diagnosztizáltak a mediasztinális nyirokcsomókban.[95][96]
Kissejtes és nem-kissejtes daganatok esetén is alkalmazható e beavatkozás palliatív terápiaként.
Alacsony stádiumú, kissejtes tüdőrákban szenvedő betegeket általában profilaktikus céllal koponya besugárzásban részesítik, megelőzendő az agyi áttétek kialakulását (PCI).[97] Azon betegekben, akiknél a sugárkezelést követően a kissejtes tüdőrák ismét kialakult, a koponya besugárzása 40,4%-ról 14,6%-ra csökkentette az agyi metasztázis kialakulásának lehetőségét.[98]
Prognózis[szerkesztés]
Nem-kissejtes tüdőrák esetén a gyógyulás esélyét befolyásolja: a meglévő légzőszervi tünetek, a tumor mérete, a szövettani diagnózis, a tumor stádiuma, lymphogén áttétek jelenléte, illetve hogy van-e vaszkuláris invázió.
Kissejtes tüdőrákok esetében további befolyásoló tényező a máj és a központi idegrendszer érintettsége (áttét).[99]
IA stádiumban lévő nem-kissejtes daganat eltávolítását követően az 5 éves túlélés esélye 67%. IB stádium esetén az érték 57%.[100] IV-es stádiumban lévő NSCLC-ben szenvedő páciensek esetén az 5 éves túlélés esélye 1%.[1]
Kissejtes tüdőrák 5 éves túlélési esélye 5%.[5] A kifejezetten rossz stádiumban lévő betegek átlagos 5 éves túlélési esélye kevesebb, mint 1%.
A tüdőrákok átlagosan 70 éves korban alakulnak ki, és a betegek többsége egy éven belül belehal a betegségbe.[101]
Jegyzetek[szerkesztés]
- ↑ a b c Lung Carcinoma: Tumors of the Lungs. Merck Manual Professional Edition, Online edition. [2007. augusztus 16-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. augusztus 15.)
- ↑ Non-Small Cell Lung Cancer Treatment –Patient Version (PDQ®). NCI , 2015. május 12. [2016. február 29-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. március 5.)
- ↑ Chapter 1, Lung Cancer—the facts, 3rd, Oxford University Press, 3–4. o. (2010). ISBN 978-0-19-956933-5
- ↑ WHO: Cancer. World Health Organization, 2006. February. (Hozzáférés: 2007. június 25.)
- ↑ a b c d e f Minna, JD, Schiller JH. Harrison's Principles of Internal Medicine, 17th, McGraw-Hill, 551–562. o. (2008). ISBN 0-07-146633-9
- ↑ Chapter 107: Neoplasms of the lung, Harrison's Principles of Internal Medicine, 19th, McGraw-Hill (2015). ISBN 978-0-07-180216-1
- ↑ Lung Cancer—Patient Version. NCI . [2016. március 9-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. március 5.)
- ↑ a b c d e Vaporciyan, AA, Nesbitt JC, Lee JS et al.. Cancer Medicine. B C Decker, 1227–1292. o. (2000). ISBN 1-55009-113-1
- ↑ (2008. szeptember 1.) „Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies”. PLoS Medicine 5 (9), e185. o. DOI:10.1371/journal.pmed.0050185. PMID 18788891.
- ↑ Gorlova, OY, Weng SF, Zhang Y et al. (2007. July). „Aggregation of cancer among relatives of never-smoking lung cancer patients”. International Journal of Cancer 121 (1), 111–118. o. DOI:10.1002/ijc.22615. PMID 17304511.
- ↑ Hackshaw, AK, Law MR, Wald NJ (1997. október 18.). „The accumulated evidence on lung cancer and environmental tobacco smoke”. British Medical Journal 315 (7114), 980–988. o. PMID 9365295.
- ↑ a b Catelinois O, Rogel A, Laurier D, et al. (2006. September). „Lung cancer attributable to indoor radon exposure in france: impact of the risk models and uncertainty analysis”. Environ. Health Perspect. 114 (9), 1361–6. o. [2009. január 20-i dátummal az eredetiből archiválva]. DOI:0.1289/ehp.9070. PMID 16966089. (Hozzáférés: 2009. december 23.)
- ↑ a b c O'Reilly, KM (2007. március 1.). „Asbestos-related lung disease”. American Family Physician 75 (5), 683–688. o. [2007. szeptember 29-i dátummal az eredetiből archiválva]. PMID 17375514.
- ↑ a b Kabir, Z, Bennett K, Clancy L (2007. February). „Lung cancer and urban air-pollution in dublin: a temporal association?”. Irish Medical Journal 100 (2), 367–369. o. PMID 17432813.
- ↑ Coyle, YM, Minahjuddin AT, Hynan LS, Minna JD (2006. September). „An ecological study of the association of metal air pollutants with lung cancer incidence in Texas”. Journal of Thoracic Oncology 1 (7), 654–661. o. PMID 17409932.
- ↑ a b Chiu, HF, Cheng MH, Tsai SS et al. (2006. December). „Outdoor air pollution and female lung cancer in Taiwan”. Inhalation Toxicology 18 (13), 1025–1031. o. DOI:10.1080/08958370600904561. PMID 16966302.
- ↑ Carmona, RH: The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General. U.S. Department of Health and Human Services, 2006. június 27. [2006. július 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2006. június 27.) „Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.”
- ↑ (2002) „Tobacco Smoke and Involuntary Smoking” (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 83, Kiadó: WHO International Agency for Research on Cancer. „There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. [...] Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).”
- ↑ Chapter 52: Epidemiology of lung cancer, Murray & Nadel's Textbook of Respiratory Medicine, 6th, Saunders Elsevier (2016). ISBN 978-1-4557-3383-5
- ↑ Carmona, RH: The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General. U.S. Department of Health and Human Services, 2006. június 27. [2017. február 15-i dátummal az eredetiből archiválva]. „Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.” Retrieved 2014-06-16
- ↑ (2004) „Tobacco Smoke and Involuntary Smoking” (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 83, Kiadó: WHO International Agency for Research on Cancer. [2015. augusztus 13-i dátummal az eredetiből archiválva]. „There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).”
- ↑ Lung Cancer Prevention–Patient Version (PDQ®). NCI , 2015. november 4. [2016. március 9-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. március 5.)
- ↑ Chapter 78: Cancer of the Lung, Holland-Frei Cancer Medicine, 8th, People's Medical Publishing House (2010). ISBN 978-1-60795-014-1
- ↑ a b Collins, LG (2007. január 1.). „Lung cancer: diagnosis and management”. American Family Physician 75 (1), 56–63. o, Kiadó: American Academy of Family Physicians. [2007. szeptember 29-i dátummal az eredetiből archiválva]. PMID 17225705.
- ↑ Chapter 31, Oxford Handbook of Respiratory Medicine, 3rd, Oxford University Press, 284. o. (2014). ISBN 978-0-19-870386-0
- ↑ World Cancer Report 2014. World Health Organization, Chapter 5.1. o. (2014. április 12.). ISBN 92-832-0429-8
- ↑ World Cancer Report 2014. World Health Organization, Chapter 1.1. o. (2014. április 12.). ISBN 92-832-0429-8
- ↑ Surveillance, Epidemiology and End Results Program. National Cancer Institute . [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. március 5.)
- ↑ Majumder, edited by Sadhan. Stem cells and cancer [archivált változat], Online-Ausg., New York: Springer, 193. o. (2009). ISBN 978-0-387-89611-3 [archiválás ideje: 2015. október 18.]
- ↑ a b c d e Travis, WD, Travis LB, Devesa SS (1995. January). „Lung cancer”. Cancer 75 (Suppl. 1), 191–202. o. DOI:<191::AID-CNCR2820751307>3.0.CO;2-Y 10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y. PMID 8000996.
- ↑ Morgagni, Giovanni Battista. De sedibus et causis morborum per anatomen indagatis (1761)
- ↑ Bayle, Gaspard-Laurent. Recherches sur la phtisie pulmonaire (francia nyelven) (1810)
- ↑ a b Witschi, H (2001. November). „A short history of lung cancer”. Toxicological Sciences 64 (1), 4–6. o. DOI:10.1093/toxsci/64.1.4. PMID 11606795.
- ↑ Adler, I. Primary Malignant Growths of the Lungs and Bronchi. Longmans, Green, and Company (1912). OCLC 14783544, cited in Spiro SG, Silvestri GA (2005). „One hundred years of lung cancer”. American Journal of Respiratory and Critical Care Medicine 172 (5), 523–529. o. DOI:10.1164/rccm.200504-531OE. PMID 15961694.
- ↑ Doll, R, Hill AB (1956. November). „Lung cancer and other causes of death in relation to smoking; a second report on the mortality of British doctors”. British Medical Journal 2 (5001), 1071–1081. o. DOI:10.1136/bmj.2.5001.1071. PMID 13364389.
- ↑ US Department of Health Education and Welfare: Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service (PDF). US Government Printing Office, 1964
- ↑ Horn, L, Johnson DH (2008. July). „Evarts A. Graham and the first pneumonectomy for lung cancer”. Journal of Clinical Oncology 26 (19), 3268–3275. o. [2020. március 17-i dátummal az eredetiből archiválva]. DOI:10.1200/JCO.2008.16.8260. PMID 18591561. (Hozzáférés: 2009. július 5.)
- ↑ Edwards, AT (1946). „Carcinoma of the bronchus”. Thorax 1 (1), 1–25. o. DOI:10.1136/thx.1.1.1.
- ↑ Lennox, SC, Flavell G, Pollock DJ et al. (1968. November). „Results of resection for oat-cell carcinoma of the lung”. Lancet 2 (7575), 925–927. o, Kiadó: Elsevier. DOI:10.1016/S0140-6736(68)91163-X. PMID 4176258.
- ↑ Miller, AB, Fox W, Tall R (1969. September). „Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus”. Lancet 2 (7619), 501–505. o, Kiadó: Elsevier. DOI:10.1016/S0140-6736(69)90212-8. PMID 4184834.
- ↑ Cohen, M, Creaven PJ, Fossieck BE Jr et al. (1977). „Intensive chemotherapy of small cell bronchogenic carcinoma”. Cancer Treatment Reports 61 (3), 349–354. o. PMID 194691.
- ↑ Lum, KL, Polansky JR, Jackler RK, Glantz SA (2008. October). „Signed, sealed and delivered: "big tobacco" in Hollywood, 1927-1951”. Tobacco Control 17 (5), 313–323. o. DOI:10.1136/tc.2008.025445. PMID 18818225.
- ↑ Parent, ME, Rousseau MC, Boffetta P et al. (2007. January). „Exposure to diesel and gasoline engine emissions and the risk of lung cancer”. American Journal of Epidemiology 165 (1), 53–62. o. DOI:10.1093/aje/kwj343. PMID 17062632.
- ↑ Liu, BQ, Peto R, Chen ZM et al. (1998. november 21.). „Emerging tobacco hazards in China: 1. Retrospective proportional mortality study of one million deaths”. British Medical Journal 317 (7170), 1411–1422. o. PMID 9822393.
- ↑ Behera, D, Balamugesh T (2004). „Lung cancer in India” (PDF). Indian Journal of Chest Diseases and Allied Sciences 46 (4), 269–281. o. [2008. december 17-i dátummal az eredetiből archiválva]. PMID 15515828. (Hozzáférés: 2009. július 5.)
- ↑ Mohr, SB, Garland CF, Gorham ED et al. (2008). „Could ultraviolet B irradiance and vitamin D be associated with lower incidence rates of lung cancer?”. Journal of Epidemiology and Community Health 62 (1), 69–74. o. DOI:10.1136/jech.2006.052571. PMID 18079336.
- ↑ Chen, F, Bina WF, Cole P (2007. April). „Declining incidence rate of lung adenokarcinóma in the United States”. Chest 131 (4), 1000–1005. o. [2008. december 6-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.06-1695. PMID 17426202. (Hozzáférés: 2009. július 5.)
- ↑ Charloux, A, Quoix E, Wolkove N et al. (1997. February). „The increasing incidence of lung adenokarcinóma: reality or artefact? A review of the epidemiology of lung adenocarcinoma”. International Journal of Epidemiology 26 (1), 14–23. o. DOI:10.1093/ije/26.1.14. PMID 9126499.
- ↑ Morandi, U, Casali C, Rossi G (2006). „Bronchial typical carcinoid tumors”. Seminars in Thoracic and Cardiovascular Surgery 18 (3), 191–198. o. DOI:10.1053/j.semtcvs.2006.08.005. PMID 17185178.
- ↑ Etienne-Mastroianni, B, Falchero L, Chalabreysse L et al. (2002. December). „Primary sarcomas of the lung: a clinicopathologic study of 12 cases”. Lung Cancer 38 (3), 283–289. o. DOI:10.1016/S0169-5002(02)00303-3. PMID 12445750.
- ↑ Subramanian, J, Govindan R (2007. February). „Lung cancer in never smokers: a review”. Journal of Clinical Oncology 25 (5), 561–570. o, Kiadó: American Society of Clinical Oncology. DOI:10.1200/JCO.2006.06.8015. PMID 17290066.
- ↑ Bryant, A, Cerfolio RJ (2007. July). „Differences in epidemiology, histology, and survival between cigarette smokers and never-smokers who develop non-small cell lung cancer”. Chest 132 (1), 198–192. o. [2008. december 6-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.07-0442. PMID 17573517. (Hozzáférés: 2009. július 5.)
- ↑ Barbone, F, Bovenzi M, Cavallieri F, Stanta G (1997. December). „Cigarette smoking and histologic type of lung cancer in men” (PDF). Chest 112 (6), 1474–1479. o, Kiadó: American College of Chest Physicians. DOI:10.1378/chest.112.6.1474. PMID 9404741.
- ↑ a b Dishop MK, Kuruvilla S (2008. July). „Primary and metastatic lung tumors in the pediatric population: a review and 25-year experience at a large children's hospital”. Arch. Pathol. Lab. Med. 132 (7), 1079–103. o. PMID 18605764.
- ↑ Greene, Frederick L.. AJCC cancer staging manual. Berlin: Springer-Verlag (2002). ISBN 0-387-95271-3
- ↑ Hamilton, W, Peters TJ, Round A, Sharp D (2005. December). „What are the clinical features of lung cancer before the diagnosis is made? A population based case-control study”. Thorax 60 (12), 1059–1065. o, Kiadó: BMJ Publishing Group. DOI:10.1136/thx.2005.045880. PMID 16227326.
- ↑ Wudel, LJ Jr., Nesbitt JC. (2001. February). „Superior vena cava syndrome.” (angol nyelven). Thorax 2 (1), 77-91. o, Kiadó: Curr Treat Options Oncol.. PMID 12057143.
- ↑ Honnorat, J, Antoine JC (2007. May). „Paraneoplastic neurological syndromes”. Orphanet Journal of Rare Diseases 2, 22. o, Kiadó: BioMed Central. DOI:10.1186/1750-1172-2-22. PMID 17480225.
- ↑ Jones, DR, Detterbeck FC (1998. July). „Pancoast tumors of the lung”. Current Opinion in Pulmonary Medicine 4 (4), 191–197. o. DOI:10.1097/00063198-199807000-00001. PMID 10813231.
- ↑ Biesalski, HK, Bueno de Mesquita B, Chesson A et al. (1998). „European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel”. CA Cancer J Clin 48 (3), 167–176; discussion 164–166. o. DOI:10.3322/canjclin.48.3.167. PMID 9594919.
- ↑ Peto, R, Lopez AD, Boreham J et al.. Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press (2006). ISBN 0-19-262535-7
- ↑ Samet, JM, Wiggins CL, Humble CG, Pathak DR (1988. May). „Cigarette smoking and lung cancer in New Mexico”. American Review of Respiratory Disease 137 (5), 1110–1113. o. PMID 3264122.
- ↑ Villeneuve, PJ, Mao Y (1994. November). „Lifetime probability of developing lung cancer, by smoking status, Canada”. Canadian Journal of Public Health 85 (6), 385–388. o. PMID 7895211.
- ↑ Hecht, S (2003. October). „Tobacco carcinogens, their biomarkers and tobacco-induced cancer”. Nature Reviews. Cancer 3 (10), 733–744. o, Kiadó: Nature Publishing Group. DOI:10.1038/nrc1190. PMID 14570033.
- ↑ Sopori, M (2002. May). „Effects of cigarette smoke on the immune system”. Nature Reviews. Immunology 2 (5), 372–7. o. DOI:10.1038/nri803. PMID 12033743.
- ↑ US Department of Health and Human Services: The Health Benefits of Smoking Cessation: a Report of the Surgeon General (PDF) pp. vi, 130, 148, 152, 155, 164, 166. Centers for Disease Control (CDC), Office on Smoking and Health., 1990. szeptember 30. (Hozzáférés: 2007. november 18.)
- ↑ Nordquist, LT, Simon GR, Cantor A et al. (2004. August). „Improved survival in never-smokers vs current smokers with primary adenokarcinóma of the lung”. Chest 126 (2), 347–351. o, Kiadó: American College of Chest Physicians. [2008. december 6-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.126.2.347. PMID 15302716. (Hozzáférés: 2009. július 5.)
- ↑ Tammemagi, CM, Neslund-Dudas C, Simoff M, Kvale P (2004. January). „Smoking and lung cancer survival: the role of comorbidity and treatment”. Chest 125 (1), 27–37. o, Kiadó: American College of Chest Physicians. [2008. december 6-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.125.1.27. PMID 14718417. (Hozzáférés: 2009. július 5.)
- ↑ CDC: 1986 Surgeon General's report: the health consequences of involuntary smoking. CDC, 1986. December. (Hozzáférés: 2007. augusztus 10.)
* National Research Council. Environmental tobacco smoke: measuring exposures and assessing health effects. National Academy Press (1986). ISBN 0-309-07456-8
* EPA (1992). „Respiratory health effects of passive smoking: lung cancer and other disorders”, Kiadó: EPA. [2010. június 30-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. augusztus 10.)
* California Environmental Protection Agency (1997). „Health effects of exposure to environmental tobacco smoke”. Tobacco Control 6 (4), 346–353. o. DOI:10.1136/tc.6.4.346. PMID 9583639.
* CDC (2001. December). „State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000”. Morbidity and Mortality Weekly Report, Atlanta, Georgia 50 (49), 1101–1106. o, Kiadó: CDC. PMID 11794619.
* Alberg, AJ, Samet JM (2003. January). „Epidemiology of lung cancer”. Chest 123 (S1), 21S–49S. o, Kiadó: American College of Chest Physicians. [2008. május 9-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.123.1_suppl.21S. PMID 12527563. (Hozzáférés: 2009. július 5.) - ↑ Report of the Scientific Committee on Tobacco and Health. Department of Health, 1998. March. (Hozzáférés: 2007. július 9.)
* Hackshaw, AK (1998. June). „Lung cancer and passive smoking”. Statistical Methods in Medical Research 7 (2), 119–136. o. DOI:10.1191/096228098675091404. PMID 9654638. - ↑ Boffetta, P, Agudo A, Ahrens W et al. (1998. October). „Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe”. Journal of the National Cancer Institute 90 (19), 1440–1450. o, Kiadó: Oxford University Press. DOI:10.1093/jnci/90.19.1440. PMID 9776409.
- ↑ National Health and Medical Research Council (1994. április 1.). „The health effects and regulation of passive smoking”, Kiadó: Australian Government Publishing Service. [2007. szeptember 29-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. augusztus 10.)
- ↑ Schick, S, Glantz S (2005. December). „Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke”. Tobacco Control 14 (6), 396–404. o. DOI:10.1136/tc.2005.011288. PMID 16319363.
- ↑ Leroux, C, Girard N, Cottin V et al.. „Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep”. Veterinary Research 38 (2), 211–228. o. DOI:10.1051/vetres:2006060. PMID 17257570.
- ↑ Palmarini, M, Fan H (2001. November). „Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer”. Journal of the National Cancer Institute 93 (21), 1603–1614. o, Kiadó: Oxford University Press. DOI:10.1093/jnci/93.21.1603. PMID 11698564.
- ↑ Cheng, YW, Chiou HL, Sheu GT et al. (2001. április 1.). „The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women”. Cancer Research 61 (7), 2799–2803. o, Kiadó: American Association for Cancer Research. PMID 11306446.
- ↑ Zheng, H, Aziz HA, Nakanishi Y et al. (2007. May). „Oncogenic role of JC virus in lung cancer”. Journal of Pathology 212 (3), 306–315. o. DOI:10.1002/path.2188. PMID 17534844.
- ↑ Giuliani, L, Jaxmar T, Casadio C et al. (2007. September). „Detection of oncogenic viruses (SV40, BKV, JCV, HCMV, HPV) and p53 codon 72 polymorphism in lung carcinoma”. Lung Cancer 57 (3), 273–281. o. DOI:10.1016/j.lungcan.2007.02.019. PMID 17400331.
- ↑ Fong, KM, Sekido Y, Gazdar AF, Minna JD (2003. October). „Lung cancer. 9: Molecular biology of lung cancer: clinical implications”. Thorax 58 (10), 892–900. o, Kiadó: BMJ Publishing Group Ltd.. DOI:10.1136/thorax.58.10.892. PMID 14514947.
- ↑ Salgia, R, Skarin AT (1998. March). „Molecular abnormalities in lung cancer”. Journal of Clinical Oncology 16 (3), 1207–1217. o. PMID 9508209.
- ↑ a b c Herbst, RS, Heymach JV, Lippman SM (2008. September). „Molecular origins of cancer: lung cancer”. N Engl J Med 359 (13), 1367–1380. o. DOI:10.1056/NEJMra0802714. PMID 18815398.
- ↑ Aviel-Ronen, S, Blackhall FH, Shepherd FA, Tsao MS (2006. July). „K-ras mutations in non-small-cell lung carcinoma: a review”. Clinical Lung Cancer 8 (1), 30–38. o, Kiadó: Cancer Information Group. DOI:10.3816/CLC.2006.n.030. PMID 16870043.
- ↑ Devereux, TR, Taylor JA, Barrett JC (1996. March). „Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors”. Chest 109 (Suppl 3), 14S–19S. o, Kiadó: American College of Chest Physicians. [2007. szeptember 29-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.109.3_Supplement.14S. PMID 8598134. (Hozzáférés: 2009. július 5.)
- ↑ Vineis, P, Hoek G, Krzyzanowski M et al. (2007. February). „Lung cancers attributable to environmental tobacco smoke and air pollution in non-smokers in different European countries: a prospective study”. Environmental Health 6, 7. o, Kiadó: BioMed Central. DOI:10.1186/1476-069X-6-7. PMID 17302981.
- ↑ A Decade of Broken Promises: The 1998 State Tobacco Settlement Ten Years Later. Campaign for Tobacco-Free Kids. (Hozzáférés: 2008. december 3.)
- ↑ Pandey, G: Bhutan's smokers face public ban. BBC, 2005. February. (Hozzáférés: 2007. szeptember 7.)
- ↑ Slatore CG, Littman AJ, Au DH, Satia JA, White E (2008). „Long-term use of supplemental multivitamins, vitamin C, vitamin E, and folate does not reduce the risk of lung cancer”. American Journal of Respiratory and Critical Care Medicine 177 (5), 524–30. o. DOI:10.1164/rccm.200709-1398OC. PMID 17989343.
- ↑ Schiller JH, Vidaver RM, Novello S, Brahmer J, Monroe L: Living with a Diagnosis of Lung Cancer. [National Lung Cancer Partnership], 2007. [2009. szeptember 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. december 1.)
- ↑ Strand, TE, Rostad H, Damhuis RA, Norstein J (2007. June). „Risk factors for 30-day mortality after resection of lung cancer and prediction of their magnitude”. Thorax 62, 991. o, Kiadó: BMJ Publishing Group. DOI:10.1136/thx.2007.079145. PMID 17573442.
- ↑ Winton, T, Livingston R, Johnson D, et al. (2005. June). „Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer”. New England Journal of Medicine 352 (25), 2589–2597. o, Kiadó: Massachusetts Medical Society. DOI:10.1056/NEJMoa043623. PMID 15972865. „Adjuvant vinorelbine plus cisplatin has an acceptable level of toxicity and prolongs disease-free and overall survival among patients with completely resected early-stage non-small-cell lung cancer.”
- ↑ Douillard, JY, Rosell R, De Lena M et al. (2006. September). „Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial”. Lancet Oncology 7 (9), 719–727. o, Kiadó: Elsevier. DOI:10.1016/S1470-2045(06)70804-X. PMID 16945766.
- ↑ Arriagada, R, Goldstraw P, Le Chevalier T. Oxford Textbook of Oncology, 2nd, Oxford University Press, 2094. o. (2002). ISBN 0-19-262926-3
- ↑ Saunders, M, Dische S, Barrett A et al. (1997. July). „Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial”. Lancet 350 (9072), 161–165. o, Kiadó: Elsevier. DOI:10.1016/S0140-6736(97)06305-8. PMID 9250182.
- ↑ Wagner, H (1998. January). „Radiation therapy in the management of limited small cell lung cancer: when, where, and how much?”. Chest 113 (Suppl. 1), 92S–100S. o, Kiadó: American College of Chest Physicians. [2007. november 9-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.113.1_Supplement.92S. PMID 9438697. (Hozzáférés: 2009. július 5.)
- ↑ (2005) „Postoperative radiotherapy for non-small cell lung cancer”. Cochrane database of systematic reviews (Online) (2), CD002142. o. [2010. február 9-i dátummal az eredetiből archiválva]. DOI:10.1002/14651858.CD002142.pub2. PMID 15846628. (Hozzáférés: 2009. július 5.)
- ↑ Lally, BE, Zelterman D, Colasanto JM et al. (2006. July). „Postoperative Radiotherapy for Stage II or III Non–Small-Cell Lung Cancer Using the Surveillance, Epidemiology, and End Results Database”. Journal of Clinical Oncology 24 (19), 2998–3006. o, Kiadó: John Wiley & Sons. DOI:10.1200/JCO.2005.04.6110. PMID 16769986.
- ↑ Ng, M, Chong J, Milner A et al. (2007. June). „Tolerability of accelerated chest irradiation and impact on survival of prophylactic cranial irradiation in patients with limited-stage small cell lung cancer: review of a single institution's experience”. Journal of Thoracic Oncology 2 (6), 506–513. o, Kiadó: International Association for the Study of Lung Cancer. DOI:10.1097/JTO.0b013e318060095b. PMID 17545845.
- ↑ Slotman, B, Faivre-Finn C, Kramer G et al. (2007. August). „Prophylactic cranial irradiation in extensive small-cell lung cancer”. New England Journal of Medicine 357 (7), 664–672. o. DOI:10.1056/NEJMoa071780. PMID 17699816.
- ↑ -Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. (Hozzáférés: 2008. november 22.)
- ↑ Mountain, CF (1997). „Revisions in the international system for staging lung cancer” (PDF). Chest 111, 1710–1717. o, Kiadó: American College of Chest Physicians. [2003. szeptember 5-i dátummal az eredetiből archiválva]. DOI:10.1378/chest.111.6.1710. PMID 9187198. (Hozzáférés: 2011. március 24.)
- ↑ Cancer Statistics Review 1975-2002 - Search. Surveillance Epidemiology and End Results (SEER). [2007. július 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. november 18.)
Külső hivatkozások[szerkesztés]
- Az Egészségügyi Minisztérium szakmai irányelve a tüdőrák és a mellhártya elsődleges rosszindulatú megbetegedéseinek diagnosztikájához és kezeléséhez – 2002.[halott link]
- Dr. Mucsi: A lappangó tüdőrák (videó)
Kapcsolódó szócikkek[szerkesztés]
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |