„Ammónium-nitrát” változatai közötti eltérés
| [nem ellenőrzött változat] | [nem ellenőrzött változat] |
úgy minden |
kémiai javítgatás |
||
| 42. sor: | 42. sor: | ||
}} |
}} |
||
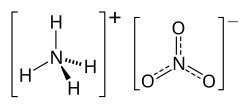
Az '''ammónium-nitrát''' szervetlen [[só]], az [[ammónia]] [[nitrát]]ja. A képlete [[ |
Az '''ammónium-nitrát''' szervetlen [[só]], az [[ammónia]] [[nitrát]]ja. A képlete [[Ammónium ion|NH<sub>4</sub>]][[Nitrátion|NO<sub>3</sub>]]. Fehér színű, kristályos, szilárd anyag, óvatosan hevítve szublimál. [[Rombos]] szerkezetű kristályokat alkot. Erősen higroszkópos vegyület. Normál körülmények közt 10 mól kristályvizet tartalmaz. [[Víz]]ben jól oldódik. Vízben való oldódása endoterm, erős hűlés tapasztalható a környezetében. Magasabb hőmérsékleten, vízmentes állapotban erős [[oxidálószer]]. [[Műtrágyázás|Műtrágyának]] és [[robbanószer]]ek készítésére használják. |
||
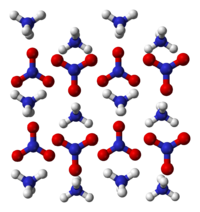
Különböző hőmérsékleten többféle kristálymódosulatban kristályosodhat<ref>{{Cite web |url=https://regi.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_521_Agrokemia_es_novved_kemia/ch03.html |title=Agrokémia |accessdate=2021 04 07}}</ref> |
Különböző hőmérsékleten többféle kristálymódosulatban kristályosodhat<ref>{{Cite web |url=https://regi.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_521_Agrokemia_es_novved_kemia/ch03.html |title=Agrokémia |accessdate=2021 04 07}}</ref> |
||
| 79. sor: | 79. sor: | ||
:<math>\mathrm{2 \ NH_4NO_3 \rightarrow 4 \ H_2O + 2 \ N_2 + O_2 }</math> |
:<math>\mathrm{2 \ NH_4NO_3 \rightarrow 4 \ H_2O + 2 \ N_2 + O_2 }</math> |
||
Könnyen éghető anyag (például [[faszén]]por, [[dinitro-benzol]]) hozzáadáskor robban. Az ammónium-nitrát és éghető anyagok keverékei biztonsági robbanószerek, mert kevésbé erélyesek, mint a [[dinamit]] és kezelésük kevésbé veszélyes. Erélyes oxidálószer, különösen megolvasztott állapotban. Az ammónium-nitrát izzó szén jelenlétében szikrázás közben sárga lánggal elég. A vörös[[foszfor]] ammónium-nitrát-olvadékban vakító fénnyel [[foszforsav]]vá [[oxidáció|oxidálódik]]. Nem-nemesfémekkel (például [[magnézium]], [[réz]], [[kadmium]], [[ón]], [[ólom]], [[kobalt]], [[nikkel]]) az ammónium-nitrát olvadéka az adott fém nitrátjává alakul, a reakció élénk. Hasonlóan reagál |
Könnyen éghető anyag (például [[faszén]]por, [[dinitro-benzol]]) hozzáadáskor robban. Az ammónium-nitrát és éghető anyagok keverékei biztonsági robbanószerek, mert kevésbé erélyesek, mint a [[dinamit]] és kezelésük kevésbé veszélyes. Erélyes oxidálószer, különösen megolvasztott állapotban. Az ammónium-nitrát izzó szén jelenlétében szikrázás közben sárga lánggal elég. A vörös[[foszfor]] ammónium-nitrát-olvadékban vakító fénnyel [[foszforsav]]vá [[oxidáció|oxidálódik]]. Nem-nemesfémekkel (például [[magnézium]], [[réz]], [[kadmium]], [[ón]], [[ólom]], [[kobalt]], [[nikkel]]) az ammónium-nitrát olvadéka az adott fém nitrátjává alakul, a reakció élénk. Hasonlóan reagál pozitív töltésű fém-oxidokkal is. |
||
:<math>\mathrm{Zn + 3 \ NH_4NO_3 \rightarrow Zn(NO_3)_2 + 2 \ NH_3 + N_2 + 3 \ H_2O}</math> |
:<math>\mathrm{Zn + 3 \ NH_4NO_3 \rightarrow Zn(NO_3)_2 + 2 \ NH_3 + N_2 + 3 \ H_2O}</math> |
||
A lap 2021. április 7., 11:03-kori változata
| Ammónium-nitrát | |
 ammónium-nitrát | |
| |
| IUPAC-név | ammónium-nitrát |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 6484-52-2 |
| RTECS szám | BR9050000 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | NH4NO3 |
| Moláris tömeg | 80,04336 g/mol |
| Megjelenés | fehér, szilárd |
| Sűrűség | 1,72 g/cm³, szilárd |
| Olvadáspont | 169,6 °C |
| Forráspont | körülbelül 210 °C-on bomlik |
| Oldhatóság (vízben) | 119 g/100 ml (0 °C) 190 g/100 ml (20 °C) 286 g/100 ml (40 °C) 421 g/100 ml (60 °C) 630 g/100 ml (80 °C) 1024 g/100 ml (100 °C) |
| Kristályszerkezet | |
| Kristályszerkezet | szabályos, tetragonális vagy rombos |
| Veszélyek | |
| EU osztályozás | Oxidáló (O)[1] |
| NFPA 704 | |
| R mondatok | R8, R9[1] |
| S mondatok | S15, S16, S41[1] |
| LD50 | 2220 mg/kg (patkány, szájon át)[1] |
| Rokon vegyületek | |
| Azonos kation | ammónium-nitrit; ammónium-perklorát |
| Azonos anion | nátrium-nitrát; kálium-nitrát; hidroxilammónium-nitrát |
| Rokon vegyületek | dinitrogén-oxid |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
Az ammónium-nitrát szervetlen só, az ammónia nitrátja. A képlete NH4NO3. Fehér színű, kristályos, szilárd anyag, óvatosan hevítve szublimál. Rombos szerkezetű kristályokat alkot. Erősen higroszkópos vegyület. Normál körülmények közt 10 mól kristályvizet tartalmaz. Vízben jól oldódik. Vízben való oldódása endoterm, erős hűlés tapasztalható a környezetében. Magasabb hőmérsékleten, vízmentes állapotban erős oxidálószer. Műtrágyának és robbanószerek készítésére használják.
Különböző hőmérsékleten többféle kristálymódosulatban kristályosodhat[2]
169,6-től -125,2 °C-ig szabályos,
125,2-től 84,2 °C-ig tetragonális,
84,2tól 32,3 °C-ig ß-rombos,
32,3-tól -16,9 °C-ig ∝-rombos,
32,3 tól -6,9 °C-ig alatt tetragonális.
Előállítása
Az ammónium-nitrát az ammónia salétromsavval való közömbösítése útján állítható elő:
Felhasználása
A vízmentes ammónium-nitrát erélyes oxidálószer, robbanószerek készítésére használható. Magas nitrogéntartalma miatt műtrágyagyártásra használják. Műtrágyaként oxidáló tulajdonsága miatt csak kristályvizes formában, általában más vegyületekkel keverve stabilizálják. A pétisó kalcium-karbonáttal és magnézium-karbonáttal kevert ammónium-nitrát.
Mint rakéta-hajtóanyag, az amerikai űrkutatási hivatal (NASA) a GPAM (Környezetbarát hajtóanyag keverék küldetés) keretében a korábban elterjedten használt hidrazin helyettesítésére a hidroxil-ammónium-nitrát (HAN, (CAS 13465-08-2) használatát teszteli. A vizes oldattal gyorsabb feltöltés és 50%-al nagyobb teljesítmény érhető el.[3]
Reakciói
keletkezése
Hevítés hatására bomlik, dinitrogén-oxid és víz keletkezik:
Magasabb hőmérsékleten a következő egyenlet szerint bomlik el:
Könnyen éghető anyag (például faszénpor, dinitro-benzol) hozzáadáskor robban. Az ammónium-nitrát és éghető anyagok keverékei biztonsági robbanószerek, mert kevésbé erélyesek, mint a dinamit és kezelésük kevésbé veszélyes. Erélyes oxidálószer, különösen megolvasztott állapotban. Az ammónium-nitrát izzó szén jelenlétében szikrázás közben sárga lánggal elég. A vörösfoszfor ammónium-nitrát-olvadékban vakító fénnyel foszforsavvá oxidálódik. Nem-nemesfémekkel (például magnézium, réz, kadmium, ón, ólom, kobalt, nikkel) az ammónium-nitrát olvadéka az adott fém nitrátjává alakul, a reakció élénk. Hasonlóan reagál pozitív töltésű fém-oxidokkal is.
Jegyzetek
- ↑ a b c d A ammónium-nitrát vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2010. október 30. (JavaScript szükséges) (angolul)
- ↑ Agrokémia. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ Index.hu: Egyszerre lehet zöldebb és hatékonyabb a NASA új rakéta-üzemanyaga
Források
- Nyilasi János: Szervetlen kémia
- Erdey-Grúz Tibor: Vegyszerismeret






