„Citromsav” változatai közötti eltérés
| [ellenőrzött változat] | [nem ellenőrzött változat] |
Nincs szerkesztési összefoglaló |
|||
| 81. sor: | 81. sor: | ||
== Gyártása == |
== Gyártása == |
||
A világon évente mintegy 1,85 millió tonna citromsavat termelnek, ezen belül 1,05 millió tonna származik [[Kína|Kínából]]. |
A világon évente mintegy 1,85 millió tonna citromsavat termelnek, ezen belül 1,05 millió tonna származik [[Kína|Kínából]]. |
||
==Kapcsolódó szócikkek== |
==Kapcsolódó szócikkek== |
||
A lap 2017. május 3., 10:23-kori változata
| Ez a szócikk részben vagy egészben a Pallas nagy lexikonából való, ezért szövege és/vagy tartalma elavult lehet.
Segíts nekünk korszerű szócikké alakításában, majd távolítsd el ezt a sablont! |
| Citromsav | |||
| |||

| |||
| IUPAC-név | 2-hidroxipropán- 1,2,3-trikarbonsav | ||
| Más nevek | Hydrogen citrate | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 77-92-9 | ||
| ATC kód | A09AB04 | ||
| Gyógyszer szabadnév | citric acid | ||
| Gyógyszerkönyvi név | Acidum citricum anhydricum, Acidum citricum monohydricum | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
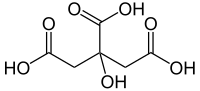
| Kémiai képlet | C6H8O7 | ||
| Moláris tömeg | 192,027 g/mol | ||
| Megjelenés | fehér kristályok | ||
| Sűrűség | 1,665 g/cm³ | ||
| Olvadáspont | 153 °C | ||
| Forráspont | 175 °C-on bomlik | ||
| Oldhatóság (vízben) | 133 g/100 ml (20 °C) | ||
| Savasság (pKa) | pKa1=3,15 pKa2=4,77 pKa3=6,40 | ||
| Veszélyek | |||
| EU osztályozás | Irritatív (Xi)[1] | ||
| NFPA 704 | |||
| R mondatok | R41[1] | ||
| S mondatok | S26, S39[1] | ||
| LD50 | 3000 mg/kg (patkány, szájon át)[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
E savat kristályos állapotban Scheele állította először elő 1784-ben, azonban a borkősavtól már 1776-ban Retzius megkülönböztette. A citromsav szabad állapotban vagy kálium-, illetőleg kalciumsó alakjában számos savanyú gyümölcsben előfordul, többnyire kevés borkősav és almasav társaságában. Szabad citromsav van a ribiszkében, vörösberkenyében, cseresznyében, málnában, szamócában, szederben, tamarindában; különösen a citrom különféle fajtái bővelkednek benne. Kálium és kalcium sóját számos növény levelében, kérgében és gyökerében találták. Ipari mértékben magas szénhidráttartalmú alapanyagokból (pl. kukorica) állítják elő, melyet savtermelő fonalas penészgomba fajokkal (pl. Aspergillus niger) fermentálnak bioreaktorokban.
A citromsav (oxi-trikarbalilsav) három bázisú szerves sav. Képlete: C3H4(OH)(COOH)3 vagy C6H8O7.
Előállítása
A citrom 6-7% szabad citromsavat tartalmaz, ezért általában csak citromlé előállítására használják. A citrom levét termelési helyén (Olaszország, Szicília, Spanyolország) nemigen dolgozzák fel, hanem besűrített állapotban bocsátják kereskedésbe; a citromsavat belőle Németországban, Angliában és Franciaországban készítik. A citrom levét előbb tojásfehérjével derítik, azután kalcium-karbonáttal és kalcium-hidroxiddal telítik. A forraláskor a különben hideg vízben oldható kalcium-citrát dús fehér csapadék alakjában leválik. A csapadékot még azon forrón a folyadéktól elválasztják, forró vízzel kimossák és centrifugális gépekben megszikkasztják. Az így kapott kalcium-citrátot azután alkalmas keverőgépekben, amelyek ólommal vannak bevonva, híg kénsavval melegen elbontják. Az oldhatatlan kalcium-szulfátról leszűrt citromsav oldatot eleinte szabad tűzön, utóbb vákuumkészülékekben erősen besűrítik és kikristályosodó, még tisztátalan citromsavat vízből újból átkristályosítva megtisztítják. A citromsavat összetevés (szintézis) útján is előállították, úgy hogy szerkezeti képlete biztonsággal ismeretes. A citromsav vízből kristályosítva színtelen, átlátszó rombuszos prizmákból áll, melyek fajsúlya 1,617 és 1 mol kristályvizet tartalmaznak.
Jellemzői
100 °C alatt kristályvizéből veszít, 100 °C-on teljesen vízmentessé válik. A kristályos citromsav 100 °C-on megolvad, a kristályvízmentes 155 °C körül. Vízben igen könnyen oldódik (3/4 súlyrészben); oldata kellemes savanyú ízű és savas kémhatású. Borszeszben is igen könnyen oldódik (1 súlyrész 90%-ban), éterben kevéssé. Hevítéskor bomlik; így 170 °C-ra felhevítve, vízvesztés folytán akonitsav keletkezik; még magasabb hőmérsékleten szén-dioxid távozik, itakonsav, citrakonsav és ezeknek anhidridjei keletkeznek. Tömény kénsav hidegen színtelenül oldja; de felmelegítéskor az oldat megbarnul. Salétromsav melegen oldja, ilyenkor oxálsav (sóskasav) és ecetsav keletkezik. Vizes oldata könnyen megpenészedik. Reakciói: ólom-acetát oldattól fehér csapadék (ólom-citrát [Pb3(C6H5O7)2·H2O] keletkezik, mely ammóniában és alkáli citrátokban könnyen feloldódik. A citromsav vizes oldata mészvízzel túltelítve átlátszó marad, mert a képződő kalcium-citrát hideg vízben oldódik, de a folyadékot felforralva, fehér csapadék keletkezik, mely hosszabb ideig tartó forralás után kristályossá válik. E csapadék a forró vízben nehezen oldható kalcium-citrát [Ca3(C6H5O7)·24H2O]. Hirtelen felhevítve megszenesedés közben szúrós szagot terjeszt, amely azonban a borkősav égetett cukorhoz hasonló szagától feltűnően különbözik. A fémek közül az alumíniumot és a vasat is megtámadja.
A citrátok családja
A citrátok igen különbözőek lehetnek, például a nátrium-citrát egy citrátsó, míg a trimetil-citrát egy észter. Elsősorban alkálifémekkel (lítium, nátrium, kálium) alkáliföldfémekkel (magnézium, kalcium) alkot vegyületeket, de léteznek például a koffeinnel, valamint egyes esetekben fémekkel (ammónium-vas-citrát) alkotott vegyületei is.
Más citrát-ionok
Mivel a citromsav három protont képes leadni, léteznek ún. köztes ionok, amikor csak egyszeres (dihidrogén-citrát H2C6H5O7‒), vagy kétszeres (hidrogén-citrát HC6H5O72‒) negatív töltésű ion keletkezik. Ezek ugyanazokkal az anyagokkal alkothatnak vegyületet, mint a háromszoros negatív töltésű citrát.
Sói
A citromsav hárombázisú sav, így tehát háromféle sója, két savanyú és egy bázisos lehetséges:
Egyes fémek (Cu, Pb) még a hidroxil (OH) csoport hidrogénjét is helyettesíthetik, de az így keletkező vegyületek nem valódi sók, hanem részben alkoholátok is. Az alkálifémek citrátjai vízben igen könnyen oldódnak és más citrátokkal kettős sókat képeznek. Különösen az ammónium-citrát a kalcium- és vasfoszfátot könnyen oldja, a szuperfoszfátok és a Thomas-salak foszforsav-tartalmának meghatározásakor használják (citrát módszer).
A magnézium-citrát Mg3(C6H5O7)2·14H2O, fehér kristályos por, mely vízben igen könnyen oldódik. Vizes oldata nem kellemetlen ízű és mégis olyan hatásos hashajtó szer, mint a keserűsó (magnéziumszulfát). A hashajtó limonádé ható alkatrésze.
A ferricitrát Fe2(C6H5O7)2·6H2O, vörösbarna amorf lemezkékből áll; vízben oldható. Gyógyszerül használják olyan esetekben, amikor vaskészítmények szedése javallott; úgyszintén kettős sóit is, így a ferriammónium-citrátot és a ferripirofoszfát-ammóniumcitrátot.
Élelmiszeripari felhasználása
Élelmiszerekben elsősorban antioxidánsként (bár önállóan nincs ilyen hatása, elősegíti a többi antioxidáns hatását), savanyúságot-szabályozó anyagként, valamint ízesítőszerként alkalmazzák E330 néven. Gyümölcsételek esetén késlelteti a gyümölcsök oxigén hatására történő elszíneződését. Napi maximum beviteli mennyisége nincs korlátozva.[2]
A hiedelemmel ellentétben semmiféle rákkeltő hatása sincs. A szervezetben természetes úton előfordul, ráadásul a DNS-hez közel, nagy koncentrációban található, így ha rákkeltő hatása lenne, szinte az összes sejtünk ráksejtté alakulna. Mi több, ez az egyik legveszélytelenebb élelmiszeripari adalékanyag. Egyszerre akár 100 gramm is elfogyasztható belőle, bár az íze ilyen mennyiségben nem túl kellemes. A félreértés valószínűleg onnan ered, hogy fő eleme a citromsav-ciklusnak, amit más néven Krebs-ciklusnak (Hans Adolf Krebs fedezte fel az 1930-as években) is szoktak nevezni. Szerencsétlen módon a rák neve németül krebs, vagyis egy téves fordítás során Szentgyörgyi-Krebs-ciklus = rák-ciklus. Ebből következtetve a fordító (hibásan) rákkeltő hatást tulajdonított a citromsavnak.[3]
Háztartási felhasználása
A citromsav kiválóan alkalmas háztartási készülékek (kávé- és teafőzők, egyéb kisgépek) vízkőmentesítésére. Ellentétben az ilyen célra a kereskedelemben kapható szerekkel, nem mérgező, könnyen elöblíthető, és közönséges élelmiszerboltban vagy gyógyszertárakban az előbbiek árának töredékéért beszerezhető. A hasonló célra használt ecetnél is sokkal alkalmasabb, mert az utóbbi íze és szaga hosszan megmarad a kitisztított készülékekben.
Gyártása
A világon évente mintegy 1,85 millió tonna citromsavat termelnek, ezen belül 1,05 millió tonna származik Kínából.
Kapcsolódó szócikkek
Jegyzetek
- ↑ a b c d A citromsav vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2011. 01. 14. (JavaScript szükséges) (angolul)
- ↑ Food-Info.net : E-numbers : E330 Citric acid
- ↑ Food-Info.net : Is citric acid (E330) carcinogenic?

