„Aromás nukleofil szubsztitúció” változatai közötti eltérés
| [ellenőrzött változat] | [ellenőrzött változat] |
+hiv |
a +hiv |
||
| 6. sor: | 6. sor: | ||
* a diazónium sóknál tapasztalt aromás [[SN1 reakció|S<sub>N</sub>1 mechanizmus]] |
* a diazónium sóknál tapasztalt aromás [[SN1 reakció|S<sub>N</sub>1 mechanizmus]] |
||
:[[image:Aromatic SN1 mechanism.svg|300px|Aromás SN1 mechanizmus]] |
:[[image:Aromatic SN1 mechanism.svg|300px|Aromás SN1 mechanizmus]] |
||
* az arin mechanizmus |
* az [[arin]] mechanizmus |
||
:[[image:Substitution via benzyne.svg|450px|Szubsztitúció arinen keresztül]] |
:[[image:Substitution via benzyne.svg|450px|Szubsztitúció arinen keresztül]] |
||
* a [[szabad gyök]]ös [[SRN1 mechanizmus|S<sub>RN</sub>1 mechanizmus]] |
* a [[szabad gyök]]ös [[SRN1 mechanizmus|S<sub>RN</sub>1 mechanizmus]] |
||
A lap 2016. szeptember 14., 21:43-kori változata

Az aromás nukleofil szubsztitúció olyan szerves kémiai szubsztitúciós reakció, melynek során egy aromás gyűrűhöz kapcsolódó jól távozó csoportot – például halogenidet – nukleofil helyettesít. Aromás rendszerek esetén 6-féle nukleofil szubsztitúciós reakció fordul elő:
- az SNAr (addíciós-eliminációs) mechanizmus
- a diazónium sóknál tapasztalt aromás SN1 mechanizmus
- az arin mechanizmus
- a szabad gyökös SRN1 mechanizmus
- az ANRORC mechanizmus
- Vicarious nukeofil szubsztitúció
Ezek közül a legjelentősebb az SNAr mechanizmus, amelyben az elektronszívó csoportok aktiválják az aromás gyűrűt a nukleofil támadásokkal szemben. Ilyen eset például, ha a távozó halogenidcsoporthoz képest orto vagy para helyzetben nitrocsoportok vannak.
SNAr reakciómechanizmus
Az aril-halogenidek nem képesek SN2 reakcióra. Mivel a szénatom síkháromszöges vegyértékállapotú, a C−Br kötés a gyűrű síkjában fekszik. A hátoldali támadáshoz a nukleofilnek a benzolgyűrű belseje felől kellene közelítenie és valamilyen abszurd módon inverziót okozni a szénatomon. Ilyen reakció nem lehetséges.[1]
Az SN1 reakció elképzelhető, de rendkívül kedvezőtlen, ehhez ugyanis a távozó csoportnak önmagától ki kellene lépnie, miközben aril kation marad vissza.[1]
Az alábbi példa a 2,4-dinitro-klórbenzol lúgos vizes közegben lejátszódó aromás nukleofil szubsztitúciós reakciójának mechanizmusa.

Ebben a sémában a szénatomok az óramutató járásával megegyezően 1–6-ig vannak számozva, az 1-es szénatom, melyhez a klorid kapcsolódik, 12 óránál található. Mivel a nitrocsoport növeli a nukleofil szubsztitúció iránti készséget, valamint meta irányító, ezért lehetővé teszi, hogy a benzolgyűrű hozzá kapcsolódó szénatomja negatív töltésű legyen. A Meisenheimer-komplexben a karbanion nemkötő elektronjai az aromás pi-rendszer részévé válnak, ami által az ipszo szén ideiglenesen kötést alakíthat ki a hidroxilcsoporttal (−OH). Az alacsonyabb energiájú állapot eléréséhez vagy a hidroxilcsoport távozik, vagy a klorid lép ki. Oldatban mindkét folyamat végbemegy. A köztitermékek kis hányadából kloridkilépés mellett termék (2,4-dinitrofenol) keletkezik, míg a maradék visszaalakul reaktánssá. Mivel a 2,4-dinitrofenol kisebb energiájú, belőle már nem fog reaktáns képződni, így némi idő elteltével a reakció egyensúlyi állapotot ér el, amelyben a 2,4-dinitrofenol van nagyobb mennyiségben jelen.
A rezonancia-stabilizált Meisenheimer-komplex keletkezése lassú lépés, mivel magasabb energiaszintet képvisel, mint az aromás kiindulási anyag. A klorid kilépése gyorsan végbemegy, mert ezzel visszaáll a gyűrű aromás rendszere.
Aromás nukleofil szubsztitúciós reakciók
Az arének néhány jellemző szubsztitúciós reakciója:
- A Bamberger-reakcióban N-fenilhidroxil-aminok átrendeződésével 4-aminofenolok keletkeznek. A nukleofil a víz.
- A Sandmeyer-reakció és a Gattermann-reakció során diazónium só reagál halogenidekkel.
- A Smiles-átrendeződés ugyanennek a reakciótípusnak az intramolekuláris változata.
Az aromás nukleofil szubsztitúció ugyanakkor nem csak arénekre korlátozódik, heteroaromás gyűrűk még készségesebben reagálnak. A piridinszármazékok különösen reakcióképesek, ha orto vagy para helyzetű szubsztituenst tartalmaznak, mivel ilyenkor a negatív töltés hatékonyan képes a nitrogénen delokalizálódni. Az egyik klasszikus példa a Csicsibabin-szintézis, melynek során a piridin alkálifém-amiddal – például nátrium-amiddal – 2-aminopiridinné alakul.[2]
A metil-3-nitropiridin-4-karboxilát vegyületben a meta helyzetű nitrocsoportot cézium-fluorid hatására 120 °C-on DMSO-ban fluorra cserélődik.[3]
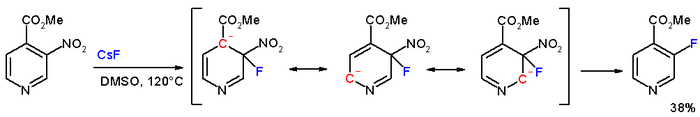
Aszimmetriás aromás nukleofil szubsztitúció
Szén nukleofilekkel, például 1,3-dikarbonil vegyületekkel végzett reakciók esetén igazolták, hogy ezzel a módszerrel királis molekulák aszimmetriás szintézise valósítható meg.[4] Az első beszámolót 2005-ben publikálták, szerves katalizátorként (mely egyben fázistranszfer katalizátorként is szolgál) a cinkonidin (N- és O-benzilezett) származékát használták.
Jegyzetek
- ↑ a b Organic Chemistry J. Clayden , Oxford University Press
- ↑ Advanced organic Chemistry, Reactions, mechanisms and structure 3ed. Jerry March ISBN 0-471-85472-7
- ↑ A Simple Synthetic Route to Methyl 3-Fluoropyridine-4-carboxylate by Nucleophilic Aromatic Substitution Freddy Tjosaas and Anne Fiksdahl Molecules 2006, 11, 130–33 Article
- ↑ Organocatalytic Regio- and Asymmetric C-Selective SNAr Reactions-Stereoselective Synthesis of Optically Active Spiro-pyrrolidone-3,3'-oxoindoles Marco Bella, Sara Kobbelgaard, and Karl Anker Jrgensen J. Am. Chem. Soc.; 2005; 127(11) pp 3670–71; (Communication) doi:10.1021/ja050200g
Fordítás
Ez a szócikk részben vagy egészben a Nucleophilic aromatic substitution című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.




