mRNS vakcina
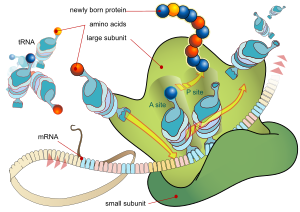

A génbázisú oltóanyagok közé tartozó mRNS vakcina az aktív immunizáción alapuló védőoltások új típusú fajtája, ami a hagyományos vektor alapú oltóanyagokkal ellentétben nem elölt, vagy legyengített vírust tartalmaz, hanem egy immunogén fehérje előállításához szükséges tranziensen jelenlevő genetikai információt, egy lipid nanorészecskébe csomagolt RNS molekulát (messenger RNS, vagy röviden mRNS).[1][2] A transzkripció során az elkészített mRNS molekula a fehérjeszintézist végző sejtszervecskéhez, a riboszómához kerül. Ez az mRNS molekula hordozza azt az információt, amit egy sejt riboszómája képes értelmezni és ez alapján fehérjét előállítani (transzláció), ami ebben az esetben egy vírus fehérjéje lesz, amit az immunrendszer idegen anyagként felismer, és kialakul a megfelelő immunválasz. Az mRNS-t úgy alakítják ki, hogy teljesen feldolgozott érett mRNS-molekulákra hasonlítson, mivel ezek természetesen előfordulnak az eukarióta sejtek citoplazmájában.[3] Ennek a megközelítésnek nagy előnye, hogy a beoltott szervezetet használja fel a vakcina az immunválaszért felelős fehérjék előállításához, mintegy biológiai gyártósort, így nincs szükség bonyolult fehérjetisztítási módszerekre, vagy vírusok külön szaporítására és kezelésére, ill. vírust vagy annak genomját pedig nem juttatják be a szervezetbe és gyorsan elő lehet őket állítani in vitro transzkripcióval, sejtmentes környezetben.[4] A technológia magában hordozza, hogy ne csak vírusellenes oltóanyagént használják, hanem minden olyan terápiában, ahol a fehérjeszintézis hatására kiváltott immunválasz fontos a betegség megfékezésében, pl. rákterápiában.[5] A vakcina úgy működik, hogy utasításokat ad a szervezet számára annak a fehérjének az előállítására, amely jelen van a vírus felületén, így az immunrendszer felismeri azt, mint idegen fehérjét, majd az antigén bemutatása után megtörténik az antitestek termelése és kialakul a vírusfertőzés ellen ható természetes immunválasz.[6][7] Mivel az mRNS nem integrálódhat a gazda genomjába, ez a tény minimalizálja a génterápiával összefüggő kiszámíthatatlan eredmények kockázatát.[8]
Továbbfejlesztett RNS alapú vakcina típusok[szerkesztés]
Önreplikálódó RNS vakcina konstrukció
A bejuttatott RNS-ben az antigén mellett olyan enzim is kódolva van, amely az RNS sejttől független replikációját lehetővé teszi, pl. az alfavírusokból származó (Togaviridae) RNS-függő RNS-polimeráz (replikáz).[9] Ez az enzim is transzlálódik a citoplazmában, majd specifikusan kapcsolódik a bejuttatott szintetikus mRNS-hez és azt többször lemásolja.[10] A kísérletek szerint így kisebb dózissal, és egyszer is elég immunizálni.[11]
Önerősítő RNS vakcina konstrukció
Az alfavirális genom két leolvasási keretét (ORF) kihasználva az első ORF által kódolt RNS-függő RNS-polimeráz mellé, a második, ún. struktúrfehérjét kódoló ORF helyére egy tetszőlegesen választott antigén kerül beépítésre, és transzláció után az intracelluláris jelerősítésben vesz részt.[12]
Bejuttatás[szerkesztés]
Az mRNS természeténél fogva biztonságos hordozómolekula (vektor), mivel az egyetlen átmeneti információhordozó, amely nem lép kölcsönhatásba a genommal. Az első kísérletek során tisztán mRNS oldatot juttattak be sejttenyészetbe.[13] Az RNS-molekulák azonban sérülékenyek, gyorsan degradálódnak, ezért hosszútávú hatást így nehéz elérni.[14] A továbbfejlesztett változatban a mRNS bejuttatására lipid nanorészecskéket használnak fel, így ezzel a módszerrel a lipid burokba ágyazott fehérjék a lipid nanorészecskéket az antigénprezentáló sejtekbe (pl. dendritikus sejtekbe) képesek irányítani.[15] A vakcina hatékonyságának javítása érdekében ezeknek a nanohordozóknak meg kell védeniük az antigéneket a korai proteolitikus lebomlástól, elő kell segíteniük az antigénfelvételt és kontrollálniuk kell az antigént bemutató sejtek által történő feldolgozást.[16]
A módszer során a szintetikus mRNS nem jut be a sejtmagba, mivel az nem tartalmaz ún. NLS-t (nukleáris lokalizációs szignált), amelynek segítségével az a sejtmagba transzportálódhatna. A másik ellenérv a genomba való beépülés ellen a molekuláris biológia centrális dogmája nevű biológiai alaptétel, amelynek értelmében a DNS-ből RNS, abból pedig fehérje lesz – azaz egyirányú az információáramlás. Ugyan van kivétel ez alól is (ld. retrovírusok működése), de ehhez az kellene, hogy a beadott mRNS mellett jelen legyen a citoplazmában egy ún. reverz transzkriptáz enzim, ill. megfelelő primer, hogy a bejuttatott RNS visszaíródjon DNS formába és dsDNS-ként be tudjon épülni a sejtmag genetikai állományába.[17][18] Tehát a bejuttatott RNS nem épülhet be a célsejt genomjába.[19] A mesterséges mRNS transzlációját és citoplazmában való megmaradását, különböző kiegészítőkkel, valamint a kellően erős immunválasz kialakulását adjuvánsokkal segítik elő.[20] Humán használatra engedélyezett adjuvánsok: aluminium sók, szkvalén (MF59C1).[21]
Összetevők[szerkesztés]


Karikó Katalin és társa, Drew Weissman kutatásai[22] is szerepet játszottak a Covid19 betegség megelőzésére a világon elsőként alkalmazott, Pfizer–BioNTech szintetikus nukleoziddal módosított mRNS védőoltás technológiai alapjainak kifejlesztésében, s azok is, akik létrehozták a BioNTech nevű céget, Özlem Türeci és Uğur Şahin.[23] Az intramuszkuláris injekcióval beadott vakcina egyetlen dózisa erős 1. típusú CD4 + és CD8 + T-sejt válaszokat, valamint hosszú életű plazma és memória B-sejt válaszokat vált ki.[22][24]
A nem természetesen sejtekben előforduló duplaszálú, vagy egyszálú RNS-ek immunogén hatásúak, és gyorsan lebontódnak. Az mRNS vakcina előállítása során ezért az uracil bázisokat egy nukleotid analógra (1-metilpszeudouridin) cserélik, le, ami segíti a mesterséges messenger RNS sejten belüli fennmaradását, és egyben transzlációt serkentő hatása is van.[25] A pszeudouridin (Ψ) egy módosított uridin (U), amelyben az uracil nevű nukleobázis nem a szokásos C-N kötéssel kapcsolódik a ribózhoz, hanem egy C-C kötéssel.[26] A vakcina tartalmazhat olyan összetevőt (pl. polietilén-glikol, vagy PEG röviden), amire nagyon ritkán, bizonyos személyek allergiás reakciót mutathatnak.[27] Ez a komponens azonban kozmetikumokban, élelmiszerekben gyógyszerekben és más oltásokban is előfordulhat,[28][29] a vakcina felhasználása ezért orvosi felügyelet mellett javallott.
A BioNTech cég Covid-19 betegség ellen védettséget biztosító mRNS vakcinájának összetétele:[30] A vakcina modRNS-szekvenciája 4284 nukleotid hosszú.[31] A Pfizer-BioNTech Comirnaty nevű vakcinája aktív immunizálásra javallott a SARS-CoV-2 vírus által okozott COVID-19-betegség megelőzésére, 16 éves, vagy idősebb személyek körében.[32] A Comirnaty esetében a SARS-Cov2 vírus felszíni tüskefehérjéjét (S, spike protein[33]) kódolja az mRNS.[34]
RNS
- Egyszálú, 5’-cap struktúrát hordozó messenger RNS (mRNS), amelyet sejtmentes in vitro transzkripcióval készítettek a SARS-CoV-2 virális tüske (spike, S) proteinjét kódoló DNS-templátokról.
Lipidek
- ((4-hidroxibutil)azanediil)bisz(hexán-6,1-diil)bisz(2-hexildekanoát) (ALC-0315), 2-[(polietilénglikol)-2000]-N,N-ditetradekilacetamid (ALC-0159), 1,2-disztearoil-sn-glicero-3-foszfokolin (DSPC), koleszterin
Sók
Egyéb
- szacharóz, injekcióhoz való víz, (pH: 6,9-7,9)
mRNS alapú vakcinák tárolása[szerkesztés]
Az RNS molekulák általánosságban mondva sérülékenyebbek a DNS molekuláknál. Utóbbiak stabilitását a kétszálú szerkezet biztosítja. RNS-ek hosszútávú tárolását alacsony hőmérsékleten lehet biztosítani, ezért −70, vagy −80 fokos fagyasztóban tárolják, ill. szállítás során szárazjégen −78 fokon. A tárolási, szállítási körülmények problémássá tehetik az RNS alapú vakcinák széles körű, globális felhasználását, ezért kutatások folynak hőstabil RNS vakcinák kifejlesztésének céljából.[35] Egy ígéretes példa lehet az I. klinikai stádiumban lévő SARS-Cov-2 ellenes mRNS típusú ARCoV vakcina jelölt.[36]
Magyar vonatkozások[szerkesztés]

Az mRNS alapú vakcinálás egyik kifejlesztője a Szegedi Tudományegyetemen végzett Dr. Karikó Katalin biológus, aki kutatásait az USA-ban folytatta. A SARS-CoV-2 ellenes védőoltás kifejlesztésében a BioNTech cég alelnökeként vett részt.[37] Az mRNS alapú vakcina továbbfejlesztésében részt vett a szintén Szegeden végzett Dr. Pardi Norbert molekuláris biológus,.[38][39] Dr. Szabó Gábor kardiológus és Dr. Boros Gábor molekuláris biológus a BioNTech cégnél segítette a vakcina fejlesztést,.[40][41] Derer Rossi a Moderna vezetője, valamint Richard Dawkins szerint Karikó és munkatársa Weissman, egyaránt megérdemlik a kémiai Nobel-díjat, mert „ez egy alapvető felfedezés.”[42][43]
Video és hanganyag a fejlesztőktől:
https://www.youtube.com/watch?v=U31Sjrk-BGA&t=2470s
https://www.youtube.com/watch?v=0ZCfk98NRI8
https://www.youtube.com/watch?v=ugxrJdp8yl0
https://www.youtube.com/watch?v=8-adIZiMt1A
Jegyzetek[szerkesztés]
- ↑ https://www.nature.com/articles/nrd.2017.243
- ↑ Jackson, Nicholas A. C., Danilo (2020. február 4.). „The promise of mRNA vaccines: a biotech and industrial perspective” (angol nyelven). npj Vaccines 5 (1), 1–6. o. DOI:10.1038/s41541-020-0159-8. ISSN 2059-0105.
- ↑ mRNA vaccines — a new era in vaccinology. (Hozzáférés: 2021. január 5.)
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3597572/
- ↑ https://pubmed.ncbi.nlm.nih.gov/28101688/
- ↑ BajtayZsuzsa: Antigén,Antigén prezentáció. (Hozzáférés: 2021. január 29.)
- ↑ 'Altered DNA' claims. (Hozzáférés: 2021. január 27.)
- ↑ Messenger of DNA, Therapeutics and Coronavirus: How are they all linked?. (Hozzáférés: 2021. január 27.)
- ↑ A koronavírus elleni vakcinák közötti különbségek. PHARMINDEX Online. (Hozzáférés: 2021. január 8.)
- ↑ (2020. október 1.) „A new generation of vaccines based on alphavirus self-amplifying RNA” (angol nyelven). Current Opinion in Virology 44, 145–153. o. DOI:10.1016/j.coviro.2020.08.003. ISSN 1879-6257.
- ↑ Vogel, Annette B., Ekaterina (2018. február 7.). „Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses” (english nyelven). Molecular Therapy 26 (2), 446–455. o. DOI:10.1016/j.ymthe.2017.11.017. ISSN 1525-0016. PMID 29275847.
- ↑ Vogel, Annette B., Ekaterina (2018. február 7.). „Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses” (english nyelven). Molecular Therapy 26 (2), 446–455. o. DOI:10.1016/j.ymthe.2017.11.017. ISSN 1525-0016. PMID 29275847.
- ↑ Developing mRNA-vaccine technologies
- ↑ Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent
- ↑ Nucleoside Modified mRNA Vaccines for Infectious Diseases
- ↑ Nanoparticle Vaccines Against Infectious Diseases. (Hozzáférés: 2021. január 27.)
- ↑ Jahanafrooz, Zohreh, Jafar (2020. március 1.). „Comparison of DNA and mRNA vaccines against cancer”. Drug Discovery Today 25 (3), 552–560. o. DOI:10.1016/j.drudis.2019.12.003. ISSN 1359-6446.
- ↑ A DNS megváltoztatása, csipbeültetés, megbetegítés, és egyéb marhaságok. (Hozzáférés: 2021. január 26.)
- ↑ No, Really, mRNA Vaccines Are Not Going To Affect Your DNA
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5906799/
- ↑ Hagyományos vakcinák. (Hozzáférés: 2021. március 20.)
- ↑ a b A Single Immunization with Nucleoside-Modified mRNA Vaccines Elicits Strong Cellular and Humoral Immune Responses against SARS-CoV-2 in Mice. (Hozzáférés: 2021. január 11.)
- ↑ The story of mRNA: How a once-dismissed idea became a leading technology in the Covid vaccine race. (Hozzáférés: 2021. január 11.)
- ↑ Penn professor's mRNA technology provides basis for Pfizer's COVID-19 vaccine. (Hozzáférés: 2021. január 26.)
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5906799/
- ↑ Wer oder was ist eigentlich Comirnaty? Oder Tozinameran?. (Hozzáférés: 2021. február 14.)
- ↑ https://pubmed.ncbi.nlm.nih.gov/33011299/
- ↑ https://www.webbeteg.hu/cikkek/fertozo_betegseg/26192/a-covid-19-elleni-vakcina-valamelyik-alkotoreszere-sulyosan-allergiasok-varjanak-meg-a-vedooltassal
- ↑ https://qubit.hu/2020/12/25/allergiat-okozhat-a-pfizer-vakcinaja-a-polietilen-glikol-az-elso-szamu-gyanusitott
- ↑ What are the Pfizer vaccine ingredients? (amerikai angol nyelven). IN.gov. (Hozzáférés: 2021. január 8.)
- ↑ Dr. Kira Smith, MD: BNT162b2Vaccine: possible codons misreading, errors in protein synthesis and alternative splicing’s anomalies. (Hozzáférés: 2021. február 14.)
- ↑ Comirnaty (Covid19 mRNS vakcina) alkalmazási előírás. (Hozzáférés: 2021. február 3.)
- ↑ S surface glycoprotein
- ↑ What’s Actually In Pfizer’s COVID-19 Vaccine?. (Hozzáférés: 2021. január 26.)
- ↑ Jones, Kathryn L., Eric J. (2007. november 1.). „Long-term storage of DNA-free RNA for use in vaccine studies”. BioTechniques 43 (5), 675–681. o. DOI:10.2144/000112593. ISSN 0736-6205. PMID 18072597.
- ↑ Zhang, Na-Na, Yong-Qiang (2020. szeptember 3.). „A Thermostable mRNA Vaccine against COVID-19” (angol nyelven). Cell 182 (5), 1271–1283.e16. o. DOI:10.1016/j.cell.2020.07.024. ISSN 0092-8674.
- ↑ https://www.wired.co.uk/article/mrna-coronavirus-vaccine-pfizer-biontech
- ↑ https://u-szeged.hu/sztehirek/2020-aprilis/koronavirus-elleni?objectParentFolderId=25255
- ↑ https://penntoday.upenn.edu/news/racing-deliver-vaccine-masses-coronavirus
- ↑ https://www.heol.hu/kozelet/helyi-kozelet/a-virus-elleni-vakcina-fejleszteseben-a-tersegunkbol-szarmazo-kutatok-is-kiveszik-a-reszuket-3182521/[halott link]
- ↑ https://index.hu/techtud/2020/07/12/magyar_kutato_a_legigeretesebb_koronavirus-vakcinat_fejleszto_ceg_alelnoke/
- ↑ The hero biochemist who pioneered COVID vaccine tech was professionally spurned for years prior. (Hozzáférés: 2021. január 28.)
- ↑ She was Demoted, Doubted and Rejected But Now Her Work is the Basis of the Covid-19 Vaccine (amerikai angol nyelven). Good News Network, 2021. február 1. (Hozzáférés: 2021. február 1.)
Források[szerkesztés]
- mRNA vaccines — a new era in vaccinology. (Hozzáférés: 2021. január 28.)
További információk[szerkesztés]
- A koronavírus elleni vakcinák közötti különbségek, pharmindex-online.hu
- Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States. cdc.gov. (Hozzáférés: 2021. február 9.)
- Pardi Norbert: Pardi, N. et al. Administration of nucleoside-modified mRNA encoding broadly neutralizing antibody protects humanized mice from HIV-1 challenge., 2017. (Hozzáférés: 2021. január 19.)
- Egy házaspár és a vakcinasztori Török származású orvosok alapították a BioNTech német vállalatot. [2021. március 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2021. február 17.)
- Comirnaty koncentrátum diszperziós injekcióhozCOVID-19 mRNS vakcina (nukleozid-módosított). (Hozzáférés: 2021. február 20.)
- Early rate reductions of SARS-CoV-2 infection and COVID-19 in BNT162b2 vaccine recipients. thelancet.com. (Hozzáférés: 2021. február 23.)
- Antonio Regalado: The next act for messenger RNA could be bigger than covid vaccines. technologyreview.com. (Hozzáférés: 2021. február 25.)
- A coronavírusok biológiája, különös tekintettel a SARS-CoV-2-re és a COVID-19-re Irodalmi összefoglaló. mta.hu. (Hozzáférés: 2021. április 7.)



