Kolisztin
| |||

| |||
| Kolisztin | |||
| IUPAC-név | |||
| N-(4-Amino-1-(1-(4-amino-1-oxo-1-(3,12,23-trisz(2-aminoetil)-20-(1-hidroxietil)-6,9-diizobutil-2,5,8,11,14,19,22-heptaoxo-1,4,7,10,13,18-hexaazaciklotrikozán-15-ilamino)bután-2-ilamino)-3-hidroxibután-2-ilamino)-1-oxobután-2-il)-N,5-dimetilheptánamid | |||
| Kémiai azonosítók | |||
| CAS-szám | 1066-17-7 | ||
| PubChem | 5311054 | ||
| ChemSpider | 4470591 | ||
| DrugBank | DB00803 | ||
| KEGG | D02138 | ||
| ATC kód | A07AA10, J01XB01 | ||
| |||
| InChIKey | YKQOSKADJPQZHB-QNPLFGSASA-N | ||
| UNII | Z67X93HJG1 | ||
| ChEMBL | 501505 | ||
| Kémiai és fizikai tulajdonságok | |||
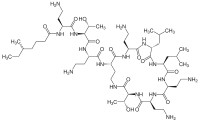
| Kémiai képlet | C52H98N16O13 | ||
| Moláris tömeg | 1155,43 g/mol | ||
| Farmakokinetikai adatok | |||
| Biohasznosíthatóság | 0% | ||
| Biológiai felezési idő |
5 óra | ||
| Terápiás előírások | |||
| Jogi státusz | Rx-only | ||
| S4 | |||
| POM | |||
| Terhességi kategória | C (US) | ||
| Alkalmazás | Helyi, orális, intravénás, intramuszkuláris, inhaláció | ||
A kolisztin, más néven polimixin E egy antibiotikum, amit a multirezisztens Gram-negatív kórokozók okozta fertőzések ellen, mint amilyen a tüdőgyulladás, használnak utolsó lehetőségként.[6][7] Ezek közt olyan baktériumok is lehetnek, mint a Pseudomonas aeruginosa, a Klebsiella pneumoniae, vagy az Acinetobacter.[8] Egyik formája, a kolisztimetát-nátrium vénába vagy izomba injekcióként is beadható, valamint belélegezhető, a másik, a kolisztin-szulfát bőrre vihető fel, illetve szájon át alkalmazható.[9] A kolisztinrezisztencia 2015-ben kezdett megjelenni.[10]
Mechanizmusa és mellékhatásai[szerkesztés]
A kolisztin az antibiotikumok polimixin osztályába tartozik.[7] A baktériumok sejtmembránját bontja le, ami azok sejthalálát okozza.[7] Injekcióval beadott formájának gyakori mellékhatásai közé tartoznak a vese- és a neurológiai problémák.[7] További komoly mellékhatások lehetnek az anafilaxis, az izomgyengeség és a Clostridium difficilével összefüggő hasmenés.[7] A belélegzett változat bronchoconstrictióhoz vezethet.[7] Nem ismert, hogy terhesség alatti használata biztonságos-e a magzat számára.[11]
Története és kulturális hatásai[szerkesztés]
A kolisztint 1947-ben fedezték fel, a kolisztimetát-nátriumot az Amerikai Egyesült Államokban 1970-ben jegyezték be.[8][7] Szerepel az Egészségügyi Világszervezet nélkülözhetetlen gyógyszereinek listáján.[12] A Világegészségügyi Szervezet a kolisztint különösen fontosnak tekinti az orvostudomány számára.[13] Generikumként is elérhető.[14] A Paenibacillus nemzetségből származó baktériumokból származik.[9]
Orvosi felhasználása[szerkesztés]
Antibakteriális spektrum[szerkesztés]
A kolisztin hatásos a Pseudomonas, Escherichia és Klebsiella-fajok okozta fertőzések kezelésében. Az alábbiakban néhány fontos mikroorganizmus szaporodásának gátlásához szükséges kolisztin mennyisége szerepel:[15][16]
- Escherichia coli: 0,12–128 μg/ml
- Klebsiella pneumoniae: 0,25–128 μg/ml
- Pseudomonas aeruginosa: ≤0,06–16 μg/ml
Például a kolisztint más gyógyszerekkel kombinálva használják, hogy a CF-betegek tüdejében lévő P. aeruginosa-fertőzést megtámadják.[17] A biofilmek felszíne alatt alacsony oxigéntartalmú környezet van, ahol a baktériumok inaktívak, és a kolisztin nagyon hatásos. Viszont a P. aeruginosa a biofilm felső rétegeiben él, ahol aktív marad.[18] Ez azért van, mert a túlélő baktériumok a felső rétegekre vándorolnak a szőrökön keresztül, és új csoportokat alkotnak a lokális denzitásérzékelés segítségével.[19]
Rezisztencia[szerkesztés]
A kolisztinrezisztencia ritka, de már leírták. Az első kolisztinrezisztencia-gént egy baktériumtörzsek közti átadódásra képes plazmidban találták meg 2011-ben Kínában, és 2015 novemberében vált először nyilvánosan ismertté.[20] A plazmidban jelen lévő mcr–1 gén jelenlétét 2015 decemberében megerősítették Délkelet-Ázsiában, néhány európai országban és az Amerikai Egyesült Államokban.[20][21] A Paenibacillus polymyxa néhány törzse terjeszti.
2017 óta nincs megegyezés arról, mettől számít egy baktérium kolisztinrezisztensnek. A Société Française de Microbiologie 2 mg/l koncentrációt használ, míg a British Society for Antimicrobial Chemotherapy 4 mg/l vagy kisebb koncentráció esetén fogékonynak tekinti a baktériumot, míg 8 mg/l vagy nagyobb koncentráció esetén rezisztensnek. Nincs sztenderd az Amerikai Egyesült Államokban a szenzitivitás mérésére.
A plazmidban lévő mcr–1 génről kiderült, hogy a kolisztinrezisztenciát kódolja.[20] Ezt a gént azóta kimutatták Kínában,[20] Európában[22] és az Amerikai Egyesült Államokban.[23]
Indiában jelentették először részletesen a kolisztinrezisztencia felbukkanását, ahol is 13 kolisztinrezisztens esetet vizsgáltak 18 hónapon át. Az eredmény az volt, hogy az összes gyógyszerre rezisztens fertőzések mortalitása, különösen azoké, amik a véráramban vannak, magasabb. Több más esetet jelentettek más indiai kórházakból.[24][25] Noha a polimixin-rezisztencia gyakorisága a legtöbb helyen kisebb 10%-nál, a Földközi-tengernél és Délkelet-Ázsiában (Koreában és Szingapúrban) nagyobb, ahol a kolisztinrezisztencia aránya folyamatosan nő.[26] 2016 májusában kolisztinrezisztens E. colit találtak az Amerikai Egyesült Államokban.[27]
A kolisztin Acetinobacter baumannii-fertőzések kezelésére való használata olyan rezisztens baktériumtörzsek kialakulásához vezetett, amik az LL-37-tel és a lizozimmel szemben is rezisztenssé váltak, amiket az emberi immunrendszer termel.[28]
Megjegyzendő, hogy nem minden rezisztenciát okoz a rezisztencia génjeinek jelenléte.[29] A heterorezisztencia, ahol látszólag genetikailag azonos mikrobák más antibiotikumokra mutatnak rezisztenciát,[30] bizonyos Enterobacter-fajokban már legalább 2016,[29] néhány Klebsiella pneumoniae-törzsben 2017–2018 óta ismert.[31] Néhány esetben e jelenségnek jelentős klinikai következményei vannak.[31]
Örökletesen rezisztens[szerkesztés]
- Brucella
- Burkholderia cepacia
- Chryseobacterium indologenes
- Edwardsiella
- Elizabethkingia meningoseptica
- Francisella tularensis spp.
- Gram-negatív coccusok
- Helicobacter pylori
- Moraxella catarrhalis
- Morganella spp.
- Neisseria gonorrhoeae és Neisseria meningitidis
- Proteus
- Providencia
- Serratia
- Néhány Stenotrophomonas maltophilia-törzs[32]
Változó rezisztencia[szerkesztés]
Mellékhatások[szerkesztés]
Az intravénás kezeléssel járó nem kívánt reakciók közé tartozik a nefrotoxicitás (vesekárosodás) és a neurotoxicitás (idegkárosodás),[33][34][35][36] de ez a gyártók jelenlegi ajánlásainál sokkal magasabb dózisoktól is lehet, valamint ahol nincs a vesebetegségekhez igazítás. A neuro- és nefrotoxikus hatások időlegesnek tűnnek, és a gyógyszeralkalmazás végeztével vagy a dózis csökkenésével véget érnek.[37]
8 óránként 160 mg-os kolisztimetát-IV-dózis mellett nagyon kis mértékű nefrotoxicitást tapasztaltak.[38][39] A kolisztin kevésbé tűnik toxikusnak az aminoglikozidoknál, amiket felváltott, és akár hat hónapon át használhatónak bizonyult mellékhatások nélkül.[40] A kolisztin okozta nefrotoxicitás különösen gyakran fordul elő hipoalbuminémiás betegeknél.[41]
A kolisztin belélegzésének a leginkább leírt fő mellékhatása a hörgőgörcs,[42] ami kezelhető vagy megelőzhető béta-2-agonisták, mint például a szalbutamol, használatával[43] vagy az érzéstelenítési protokoll követésével.[44]
Farmakokinetika[szerkesztés]
A kolisztin nem szívódik fel klinikailag hasznos mértékben a bélrendszerben. Ezért fertőzés esetén injekción át kell beadni. A kolisztimetátot a vese kiválasztja, de a kolisztin a vesén kívül ürül, aminek a mechanizmusát még nem írták le.[45][46]
Története[szerkesztés]
A kolisztint először Japánban mutatta ki Kojama japán tudós 1949-ben egy palacknyi Bacillus polymyxa var. colistinusból,[47] és 1959-ben vált klinikai alkalmazásokra hozzáférhetővé.[48]
Egy kevésbé mérgező prekurzor, a kolisztimetát-nátrium 1959-ben vált elérhetővé injekcióként. Az 1980-as években a polimixinek használatát széles körben megszüntették a nefro- és neurotoxicitás miatt. Ahogy a multirezisztens baktériumok egyre gyakoribbá váltak az 1990-es években, a kolisztint újra elkezdték használni a mérgező hatások ellenére.[49]
Bioszintézise[szerkesztés]
A kolisztin bioszintéziséhez treonin, leucin és 2,4-diaminovajsav szükséges. A kolisztin lineáris prekurzorának szintézise a ciklizáció előtt kell, hogy megtörténjen. A nemriboszomálispeptid-bioszintézis egy indítódoménnel kezdődik, majd a soron következő aminosavak hozzáadásával folytatódik. Ezek az aminosavak egy adenilációs domén (A), egy peptidilhordozófehérje-domén (PCP), egy epimerizációs domén (E) és egy kondenzációs domén (C) segítségével kerülnek a molekulára. A ciklizáció egy tioészteráz segítségével történik.[50] Az első lépés, hogy az A és PCP domének kapcsolódnak a 6-metilheptánsavhoz, majd a C, A és PCP kapcsolódik a 2,4-diaminovajsavhoz. Ez a folyamat folytatódik a többi aminosavval, amíg a lineáris peptidlánc elkészül. Az utolsó doménen tioészteráz van, ami a ciklizációt végrehajtja, s a kolisztint létrehozza.

Jegyzetek[szerkesztés]
- ↑ Colobreathe 1,662,500 IU inhalation powder, Hard Capsules - Summary of Product Characteristics (SmPC). (emc) . (Hozzáférés: 2020. november 16.)
- ↑ Colomycin 1 million International Units (IU) Powder for solution for injection, infusion or inhalation - Summary of Product Characteristics (SmPC). (emc) , 2020. május 27. (Hozzáférés: 2020. november 16.)
- ↑ Promixin 1 million International Units (IU) Powder for Nebuliser Solution - Summary of Product Characteristics (SmPC). (emc) , 2020. szeptember 23. (Hozzáférés: 2020. november 16.)
- ↑ Coly-Mycin M- colistimethate injection. DailyMed , 2018. december 3. (Hozzáférés: 2020. november 16.)
- ↑ Colobreathe EPAR. Európai Gyógyszerügynökség . (Hozzáférés: 2020. november 16.)
- ↑ (2017. április) „Clinical considerations for optimal use of the polymyxins: A focus on agent selection and dosing.”. Clinical Microbiology and Infection 23 (4), 229–233. o. DOI:10.1016/j.cmi.2017.02.023. PMID 28238870.
- ↑ a b c d e f g Colistimethate Sodium Monograph for Professionals. Drugs.com . (Hozzáférés: 2019. november 6.)
- ↑ a b M. E. Falagas, A. P. Grammatikos, A. Michalopoulos (2008. október 1.). „Potential of old-generation antibiotics to address current need for new antibiotics”. Expert Review of Anti-infective Therapy 6 (5), 593–600. o. DOI:10.1586/14787210.6.5.593. PMID 18847400.
- ↑ a b Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases E-Book. Elsevier Health Sciences, 469. o. (2009. április 2.). ISBN 9781437720600
- ↑ (2015. december 10.) „Detection of mcr-1 encoding plasmid-mediated colistin-resistant Escherichia coli isolates from human bloodstream infection and imported chicken meat, Denmark 2015” (angol nyelven). Eurosurveillance 20 (49), 30085. o. DOI:10.2807/1560-7917.ES.2015.20.49.30085. ISSN 1560-7917. PMID 26676364.
- ↑ Colistimethate (Coly Mycin M) Use During Pregnancy. Drugs.com . (Hozzáférés: 2019. november 11.)
- ↑ (World Health Organization). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO (2019)
- ↑ ((World Health Organization)). Critically important antimicrobials for human medicine, 6th revision, Geneva: World Health Organization (2019). ISBN 9789241515528
- ↑ British national formulary: BNF 76, 76, Pharmaceutical Press, 547. o. (2018. április 2.). ISBN 9780857113382
- ↑ Polymyxin E (Colistin) - The Antimicrobial Index Knowledgebase - TOKU-E. [2016. május 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. május 28.)
- ↑ Archived copy. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. február 10.)
- ↑ G. Herrmann, L. Yang, H. Wu, Z. Song, H. Wang, N. Høiby, M. Ulrich, S. Molin, J. Riethmüller, G. Döring (2010). „Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa”. J. Infect. Dis. 202 (10), 1585–92. o. DOI:10.1086/656788. PMID 20942647.
- ↑ S. J. Pamp, M. Gjermansen, H. K. Johansen, T. Tolker-Nielsen (2008). „Tolerance to the antimicrobial peptide colistin in Pseudomonas aeruginosa biofilms is linked to metabolically active cells, and depends on the pmr and mexAB-oprM genes”. Molecular Microbiology 68 (1), 223–240. o. DOI:10.1111/j.1365-2958.2008.06152.x. PMID 18312276.
- ↑ S. L. Chua, J. K. Yam, K. S. Sze, L. Yang (2016). „Selective labelling and eradication of antibiotic-tolerant bacterial populations in Pseudomonas aeruginosa biofilms”. Nat Commun 7, 10750. o. DOI:10.1038/ncomms10750. PMID 26892159.
- ↑ a b c d Y. Y. Liu, Y. Wang, T. R. Walsh, L. X. Yi, R. Zhang, J. Spencer, Y. Doi, G. Tian, B. Dong, X. Huang, L. F. Yu, D. Gu, H. Ren, X. Chen, L. Lv, D. He, H. Zhou, Z. Liang, J. H. Liu, J. Shen (2016). „Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study”. Lancet Infect Dis 16 (2), 161–8. o. DOI:10.1016/S1473-3099(15)00424-7. PMID 26603172.
- ↑ Zhang, Sarah. „Resistance to the Antibiotic of Last Resort Is Silently Spreading”, The Atlantic . [2017. január 13-i dátummal az eredetiből archiválva] (Hozzáférés ideje: 2017. január 12.)
- ↑ Maryn McKenna: Apocalypse Pig Redux: Last-Resort Resistance in Europe. Phenomena, 2015. december 3. [2016. május 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. május 28.)
- ↑ First discovery in United States of colistin resistance in a human E. coli infection. www.sciencedaily.com . [2016. május 27-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. május 27.)
- ↑ Emergence of Pan drug resistance amongst gram negative bacteria! The First case series from India, 2014. december 1.
- ↑ New worry: Resistance to 'last antibiotic' surfaces in India, 2014. december 28. [2014. december 31-i dátummal az eredetiből archiválva].
- ↑ A. Z. Bialvaei, H. Samadi Kafil (2015. március 19.). „Colistin, mechanisms and prevalence of resistance”. Curr Med Res Opin 31 (4), 707–21. o. DOI:10.1185/03007995.2015.1018989. PMID 25697677.
- ↑ Discovery of first mcr-1 gene in E. coli bacteria found in a human in United States. cdc.gov. U.S. Department of Health and Human Services, 2016. május 31. [2016. július 11-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. július 6.)
- ↑ B. A. Napier, E. M. Burd, S. W. Satola, S. M. Cagle, S. M. Ray, P. McGann, J. Pohl, E. P. Lesho, D. S. Weiss (2013. május 21.). „Clinical Use of Colistin Induces Cross-Resistance to Host Antimicrobials in Acinetobacter baumannii”. mBio 4 (3), e00021–13–e00021–13. o. DOI:10.1128/mBio.00021-13. PMID 23695834.
- ↑ a b Common 'Superbug' Found to Disguise Resistance to Potent Antibiotic. wsj.com. Wall Street Journal, 2018. március 6. [2018. április 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. november 1.)
- ↑ O. M. El-Halfawy, M. A. Valvano (2015). „Antimicrobial Heteroresistance: an Emerging Field in Need of Clarity”. Clinical Microbiology Reviews 28 (1), 191–207. o. DOI:10.1128/CMR.00058-14. PMID 25567227.
- ↑ a b V. I. Band, S. W. Satola, E. M. Burd, M. M. Farley, J. T. Jacob, D. S. Weiss (2018). „Carbapenem-Resistant Klebsiella pneumoniae Exhibiting Clinically Undetected Colistin Heteroresistance Leads to Treatment Failure in a Murine Model of Infection”. mBio 9 (2), e02448–17. o. DOI:10.1128/mBio.02448-17. PMID 29511071.
- ↑ N. Markou, H. Apostolakos, C. Koumoudiou, M. Athanasiou, A. Koutsoukou, I. Alamanos, L. Gregorakos (2003). „Intravenous colistin in the treatment of sepsis from multiresistant Gram-negative bacilli in critically ill patients”. Crit Care 7 (5), R78–83. o. DOI:10.1186/cc2358. PMID 12974973.
- ↑ E. Wolinsky, J. D. Hines (1962). „Neurotoxic and nephrotoxic effects of colistin in patients with renal disease”. N Engl J Med 266 (15), 759–68. o. DOI:10.1056/NEJM196204122661505. PMID 14008070.
- ↑ J. Koch-Weser, V. W. Sidel, E. B. Federman, P. Kanarek, D. C. Finer, A. E. Eaton (1970). „Adverse effects of sodium colistimethate. Manifestations and specific reaction rates during 317 courses of therapy”. Annals of Internal Medicine 72 (6), 857–68. o. DOI:10.7326/0003-4819-72-6-857. PMID 5448745.
- ↑ M. J. Ledson, M. J. Gallagher, C. Cowperthwaite, R. P. Convery, M. J. Walshaw (1998). „Four years' experience of intravenous colomycin in an adult cystic fibrosis unit”. Eur Respir J 12 (3), 592–4. o. DOI:10.1183/09031936.98.12030592. PMID 9762785.
- ↑ J. Li, R. L. Nation, R. W. Milne, J. D. Turnidge, K. Coulthard (2005). „Evaluation of colistin as an agent against multi-resistant Gram-negative bacteria”. Int J Antimicrob Agents 25 (1), 11–25. o. DOI:10.1016/j.ijantimicag.2004.10.001. PMID 15620821.
- ↑ P. Beringer (2001). „The clinical use of colistin in patients with cystic fibrosis”. Curr Opin Pulm Med 7 (6), 434–40. o. DOI:10.1097/00063198-200111000-00013. PMID 11706322.
- ↑ S. P. Conway, C. Etherington, J. Munday, M. H. Goldman, J. J. Strong, M. Wootton (2000). „Safety and tolerability of bolus intravenous colistin in acute respiratory exacerbation in adults with cystic fibrosis”. Annals of Pharmacotherapy 34 (11), 1238–42. o. DOI:10.1345/aph.19370. PMID 11098334.
- ↑ J. M. Littlewood, C. Koch, P. A. Lambert, N. Høiby, J. S. Elborn, S. P. Conway, R. Dinwiddie, F. Duncan-Skingle (2000). „A ten year review of Colomycin”. Respir. Med. 94 (7), 632–40. o. DOI:10.1053/rmed.2000.0834. PMID 10926333.
- ↑ A. Stein, D. Raoult (2002). „Colistin: an antimicrobial for the 21st century?”. Clin Infect Dis 35 (7), 901–2. o. DOI:10.1086/342570. PMID 12228836.
- ↑ (2018. december 1.) „Hypoalbuminemia as a predictor of acute kidney injury during colistin treatment”. Scientific Reports 8 (1), 11968. o. DOI:10.1038/s41598-018-30361-5. ISSN 2045-2322. PMID 30097635.
- ↑ J. Maddison, M. Dodd, A. K. Webb (1994). „Nebulized colistin causes chest tightness in adults with cystic fibrosis”. Respir. Med. 88 (2), 145–7. o. DOI:10.1016/0954-6111(94)90028-0. PMID 8146414.
- ↑ W. Kamin, A. Schwabe, I. Krämer (2006). „Inhalation solutions: which one are allowed to be mixed? Physico-chemical compatibility of drug solutions in nebulizers”. J. Cyst. Fibros. 5 (4), 205–213. o. DOI:10.1016/j.jcf.2006.03.007. PMID 16678502.
- ↑ J. Domínguez-Ortega, E. Manteiga, C. Abad-Schilling, M. A. Juretzcke, J. Sánchez-Rubio, C. Kindelan (2007). „Induced tolerance to nebulized colistin after severe reaction to the drug”. J Investig Allergol Clin Immunol 17 (1), 59–61. o. PMID 17323867.
- ↑ J. Li, R. W. Milne, R. L. Nation, J. D. Turnidge, T. C. Smeaton, K. Coulthard (2004). „Pharmacokinetics of colistin methanesulphonate and colistin in rats following an intravenous dose of colistin methanesulphonate”. J Antimicrob Chemother 53 (5), 837–40. o. DOI:10.1093/jac/dkh167. PMID 15044428.
- ↑ (2003) „Use of High-Performance Liquid Chromatography To Study the Pharmacokinetics of Colistin Sulfate in Rats following Intravenous Administration”. Antimicrob Agents Chemother 47 (5), 1766–70. o. DOI:10.1128/AAC.47.5.1766-1770.2003. PMID 12709357.
- ↑ Y. Koyama, A. Kurosasa, A. Tsuchiya, K. Takakuta (1950). „A new antibiotic 'colistin' produced by spore-forming soil bacteria”. J Antibiot (Tokyo) 3.
- ↑ Colistin: An overview. www.uptodate.com . [2016. május 31-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. június 6.)
- ↑ M. Falagas, S. Kasiakou (2005). „Colistin: The Revival of Polymyxins for the Management of Multidrug-Resistant Gram-Negative Bacterial Infections”. Clinical Infectious Diseases 40 (9), 1333–41. o. DOI:10.1086/429323. PMID 15825037.
- ↑ Dewick, Paul M, Medicinal Natural Products, Third Edition, John Wiley & Sons, 2009
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Colistin című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
- Reardon, Sara (2015. december 1.). „Spread of antibiotic-resistance gene does not spell bacterial apocalypse — yet”. Nature. DOI:10.1038/nature.2015.19037.
- Colistimethate sodium. Drug Information Portal. U.S. National Library of Medicine
- Colistin sulfate. Drug Information Portal. U.S. National Library of Medicine
- Colistin topics page (bibliography). Science.gov
