Cirkónium(IV)-klorid
| Cirkónium(IV)-klorid | |
| |
| |
| IUPAC-név | Cirkónium-tetraklorid Cirkónium(IV)-klorid |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 10026-11-6 |
| ChemSpider | 23202 |
| EINECS-szám | 233-058-2 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | ZrCl4 |
| Moláris tömeg | 233,04 g/mol |
| Megjelenés | fehér kristályok higroszkópos |
| Sűrűség | 2,80 g/cm³ |
| Olvadáspont | 437 °C (hármasponton) |
| Forráspont | 331 °C (szublimál) |
| Oldhatóság (vízben) | Hidrolizál |
| Oldhatóság | Oldható alkoholban, dietil-éterben, tömény sósavban |
| Kristályszerkezet | |
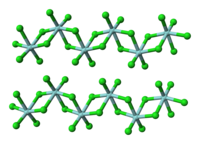
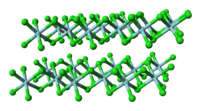
| Kristályszerkezet | Monoklin, mP10 |
| Tércsoport | P12/c1, No. 13 |
| Termokémia | |
| Std. képződési entalpia ΔfH |
-980,52 kJ/mol |
| Standard moláris entrópia S |
181,41 J K-1 mol- |
| Hőkapacitás, C | 125,38 J K-1 mol-1 |
| Veszélyek | |
| MSDS | MSDS |
| EU Index | Korrozív (C)[1] |
| R mondatok | R14, R22, R34[1] |
| S mondatok | S26, S36/37/39, S45, S8[1] |
| Lobbanáspont | Nem gyúlékony |
| LD50 | 1688 mg/kg (patkány, szájon át) 489 mg/kg (egér, szájon át)[2] |
| Rokon vegyületek | |
| Azonos kation | Cirkónium(IV)-fluorid Cirkónium(IV)-bromid Cirkónium(IV)-jodid |
| Azonos anion | Titán-tetraklorid Hafnium-tetraklorid |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A cirkónium(IV)-klorid, más néven cirkónium-tetraklorid (ZrCl4) egy szervetlen anyag, amelyet gyakran használnak más cirkóniumvegyületek alapanyagaként. Fehér, magas olvadáspontú szilárd anyag, a levegő nedvességtartalmától gyorsan elhidrolizál.
Szerkezet[szerkesztés]
A molekuláris TiCl4-gyel ellentétben (melyben minden Ti tetraéderesen koordinált), a szilárd ZrCl4 polimer szerkezetű; minden Zr oktaéderesen koordinált. Emiatt a szerkezeti különbség miatt tulajdonságaik nagyban eltérnek: a TiCl4 desztillálható folyadék, míg a ZrCl4 magas olvadáspontú szilárd anyag. Szilárd fázisban a ZrCl4 szalagszerű lineáris polimer, hasonlóan a HfCl4-hez. A polimerszerkezet könnyen megbontható Lewis-bázisokkal, melyek a Zr-atomokhoz koordinálódva felhasítják a Zr-Cl-Zr hidakat.[3]
Szintézis[szerkesztés]
Iparilag cirkónium-dioxidból állítják elő szénnel (mint oxigénelvonó szerrel) és klórgázzal.
- ZrO2 + 2 C + 2 Cl2 → ZrCl4 + 2 CO
Laboratóriumi méretben szén-tetraklorid is használható szén és klór helyett:[4]
- ZrO2 + 2 CCl4 → ZrCl4 + 2 COCl2
Alkalmazások[szerkesztés]
Alapanyag fémcirkónium és ZrCl3 előállításához[szerkesztés]
A ZrCl4 a cirkóniumércekből Kroll-eljárással történő cirkóniumgyártás köztiterméke. A természetben a cirkónium kizárólag oxidos ásványokban fordul elő (ezt a cirkóniumvegyületek hidrolízis iránti nagyfokú hajlama is tükrözi). A cirkónium kinyeréséhez ezeket először ZrCl4-gyé kell alakítani, ami magas hőmérsékleten kidesztillálható (és desztilációval tisztítható). A kapott ZrCl4-et ezután fém Mg-mal vagy Na-mal inert atmoszféra alatt redukálják ciróniumfémmé.
A tisztított ZrCl4 fémcirkóniummal cirkónium(III)-kloriddá redukálható.
Felhasználás egyéb célokra[szerkesztés]
A ZrCl4 a leggyakoribb prekurzor a cirkónium-dioxid és a cirkónium-diborid kémiai gőzfázisú rétegleválasztással (Chemical Vapor Deposition, CVD) történő előállításánál.[5]
Szerves szintézisekben a cirkónium-tetraklorid gyenge Lewis-savként használható Friedel-Crafts-reakciókban, Diels-Alder reakciókban és intramolekuláris gyűrűzárási reakciókban.[6] Textíliák és más szálas anyagok víztaszítóvá tételéhez is használják.
Az izzadásgátlókban gyakran előforduló "aluminium zirconium tetrachlorohydrex gly" nevű összetevő (nem teljesen sztöchiometrikus bázisos alumínium-cirkónium-klorid-glicinát, közelítő képlete Al4Zr(OH)12Cl4(H2NCH2COOH)*yH2O[7]) előállításához ZrOCl2-t, illetve ZrO(OH)Cl-t használnak,[8] amelyek ZrO2 sósavas kezelése mellett ZrCl4 hidrolízisével is előállíthatóak.
Tulajdonságok és reakciók[szerkesztés]
A ZrCl4 hidrolízisekor a cirkonil-kloridnak nevezett hidratált cirkónium-hidroxid-klorid klaszter keletkezik (gyakran használt egyszerűsített képlete ZrOCl2*8H2O, pontosabb képlet: [Zr4(OH)8(H2O)16]Cl8(H2O)12). A reakció gyors és lényegében irreverzibilis, ami a cirkónium(IV) nagy oxofilitására vezethető vissza. Emiatt a cirkónium-tetrakloriddal való munka általában a levegő (és a nedvesség) teljes kizárását igényli.
A ZrCl4 inert oldószerben (pl. benzolban) β-diketonokkal, pl. acetilacetonnal reagáltatva ZrCl2(β-diketonát)2 összetételű oktaéderes cisz-dikloridokat képez:[3]
- ZrCl4 + 2 CH3COCH2COCH3 → ZrCl2(acac)2 + 2 HCl (acac=acetilacetonát)
A ZrCl4 alapvető kiindulási anyaga számos fémorganikus cirkóniumvegyület szintézisének.[9] Polimer szerkezete miatt a ZrCl4-et általában molekuláris szerkezetű komplexekké alakítják használat előtt. Például tetrahidrofuránnal 175-177 °C-on olvadó ZrCl4(THF)2 komplexet (THF=tetrahidrofurán) képez (CAS szám: 21959-01-3).[10] Ezt nátrium-ciklopentadieniddel reagáltatva a sokoldalúan továbbalakítható cirkonocén-diklorid képződik:[11]
- NaC5H5 + ZrCl4(THF)2 → ZrCl2(C5H5)2 + 2 NaCl + 2 THF
A ZrCl4 egyik legérdekesebb tulajdonsága jó oldhatósága metilezett benzolszármazékokban, pl. durolban. Ennek oka π-komplexek képződése.[12]
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Zirconium(IV) chloride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek[szerkesztés]
- ↑ a b c http://www.guidechem.com/dictionary/en/10026-11-6.html
- ↑ MSDS
- ↑ a b N. N. Greenwood & A. Earnshaw, Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, Oxford, 1997.
- ↑ W. S. Hummers, S. Y. Tyree, S. Yolles "Zirconium and Hafnium Tetrachlorides" Inorganic Syntheses, 1953, Volume IV, 121. doi:10.1002/9780470132357.ch41
- ↑ E. Randich , “Chemical vapor deposited borides of the form (Ti,Zr)B2 and (Ta,Ti)B2,” Thin Solid Films Volume 63, Issue 2, 1 November 1979, Pages 309–313.
- ↑ Bora U. (2003). „Zirconium Tetrachloride”. Synlett (7), 1073–1074. o. DOI:10.1055/s-2003-39323.
- ↑ http://www.parchem.com/chemical-supplier-distributor/Aluminium-Zirconium-Tetrachlorohydrex-Gly-ZIRKONAL-P4G-007302.aspx
- ↑ http://www.hc-sc.gc.ca/cps-spc/pubs/indust/cosmet-antiperspir-sudorif/index-eng.php
- ↑ New Aspects of Zirconium Containing Organic Compounds. Topics in Organometallic Chemistry, 10 Edited by Ilan Marek (Technion-Israel Institute of Technology, Haifa). Springer: Berlin, Heidelberg, New York. 2005. x + 176 pp. ISBN 3-540-22221-9.
- ↑ L. E. Manzer, Joe Deaton (1982). „Tetrahydrofuran Complexes of Selected Early Transition Metals”. Inorganic Syntheses 21, 135–140. o. DOI:10.1002/9780470132524.ch31.
- ↑ G. Wilkinson and J.G. Birmingham (1954). „Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta”. J. Am. Chem. Soc. 76 (17), 4281–4284. o. DOI:10.1021/ja01646a008.
- ↑ Musso, F.; Solari, E.; Floriani, C.; Schenk, K. (1997). „Hydrocarbon Activation with Metal Halides: Zirconium Tetrachloride Catalyzing the Jacobsen Reaction and Assisting the Trimerization of Alkynes via the Formation of η6-Arene-Zirconium(IV) Complexes”. Organometallics 16 (22), 4889–4895. o. DOI:10.1021/om970438g.
