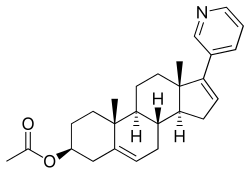
Abirateron-acetát
| |||
| Abirateron-acetát | |||
| IUPAC-név | |||
| [(3S,8R,9S,10R,13S,14S)-10,13-dimetil-17-(piridin-3-il)-2,3,4,7,8,9,11,12,14,15-dekahidro-1H-ciklopenta[a]fenantrén-3-il]-acetát | |||
| Más nevek | CB-7630; JNJ-212082; [17-(3-piridinil)androszta-5,16-dién-3β-il]-acetát | ||
| Kémiai azonosítók | |||
| CAS-szám | 154229-18-2, 154229-19-3 (abirateron) | ||
| PubChem | 9821849 | ||
| ChemSpider | 7997598 | ||
| DrugBank | DB05812 | ||
| KEGG | D09701 | ||
| ChEBI | 68639 | ||
| ATC kód | L02BX03 | ||
| |||
| InChIKey | UVIQSJCZCSLXRZ-UBUQANBQSA-N | ||
| UNII | EM5OCB9YJ6 | ||
| ChEMBL | 271227 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C26H33NO2 | ||
| Moláris tömeg | 391.555 g/mol | ||
| Olvadáspont | 144–145 °C [4] | ||
| Farmakokinetikai adatok | |||
| Biohasznosíthatóság | Nem ismert, 50% éhgyomor esetén[2] | ||
| Metabolizmus | Észteráz, CYP3A4, SULT2A1[3] | ||
| Biológiai felezési idő |
Abirateron: 12–24 óra[1][2] | ||
| Fehérjekötés | Abirateron: ~99.8% (a albumin és α1-AGp[1][2][3] | ||
| Kiválasztás | Széklet: ~88%[1][3] Vizelet: ~5%[1][3] | ||
| Terápiás előírások | |||
| Licenc adat | abirateron (USA) | ||
| Igen (EU) | |||
| Jogi státusz | Vényköteles | ||
| S4 | |||
| POM | |||
| Vényköteles | |||
| Terhességi kategória | X (US) | ||
| D (AU) | |||
| Alkalmazás | szájon át (tabletta)[1] | ||
Az abirateron-acetát egy antiandrogén gyógyszerhatóanyag, amely többek között Zytiga néven van forgalomban és prosztatarák kezelésére használják. Elsősorban a kasztrációval és prednizolonnal együtt alkalmazzák metasztázisos kasztrációrezisztens prosztatarák (mCRPC) és a metasztázisos nagy kockázatú kasztrációrezisztens prosztatarák (mCSPC) kezelésére.[1] Szájon át történő adagolása éhgyomorra javasolt napi egyszeri alkalommal.[1] Egy másik, szintén kereskedelmi forgalomban levő készítmény a Yonsa, amely étkezés közben vagy után is alkalmazható alacsony dózisban.[5]
Az abirateron-acetát alkalmazása esetén jelentkező gyakoribb mellékhatások a fáradtság, ízületi gyulladás, magas vérnyomás, hányás, ödéma, hypokalaemia, hasmenés, köhögés, fejfájás, mellékvesekéreg-elégtelenség, hiperaldoszteronizmus, májkárosodás.[1] Mint androgénszintézist gátló – különösen, mint CYP17A1 gátló – gátolja az androgénhormonok képződését a szervezetben, így a tesztoszteron és a dihidrotesztoszteron termelődését.[1]
Az abirateron-acetátot 1993-ban szintetizálták, használata engedélyezett gyógyszerként 2011-ben volt.[6][7][8] Az mCRPC kezelésre 2011-ben vezették be, majd 2018-ban az mCSPC kezelésére is elfogadták.[9] Mára már globális mértékben elterjedt és fogalmazott gyógyszerré vált.[10]
Orvosi felhasználás[szerkesztés]
Prosztatarák[szerkesztés]
Az abirateron-acetátot prednizonnal együtt alkalmazzák mCRPC kezelésére (korábban hormon-rezisztens vagy hormon-refrakter prosztataráknak is nevezték).[1][11][12][13] Az ilyen típusú prosztatarák nem reagál sem az androgén-deprivációs terápiára, sem az androgénreceptor-antagonistákra. Az abirateron-acetátot az FDA (2011 április 28-án), az EMA (2011 szeptember 23-án), az MHRA (2011 szeptember 5-én) és a TGA (2012 március 1-én) fogadta el terápiás célú felhasználásra.[1][11][12][13] Ausztráliában kasztráció-rezisztens prosztatarák kezelésére alkalmazzák prednizonnal kombinálva.[14]
Az abirateron-acetátot prosztatarák kezelése esetén a tesztoszteronszint-emelkedés megakadályozására is alkalmazzák gonadotropinfelszabadító hormon antagonista terápia során.[15]
Klinikai hatékonyság[szerkesztés]
Az első fázis III. klinikai vizsgálat 2008-ban kezdődött előzőleg docetaxellel kezelt páciensek részvételével.[16] Egy független bizottság 2010 szeptemberében azt találta, hogy azoknál a betegeknél, akik előzőleg docetaxellel voltak kezelve, az átmeneti eredmények sokkal jobbak voltak, mint azoknál, akik csak placebót kaptak, így ezért a vizsgálatok további placebókontrollos folytatása nem lett volna etikus, ezért a többi beteg szintén részesült a hatóanyagból. Az általános túlélési esély 3,9 hónappal növekedett e tanulmány során (14,8 hónap a placebo kontrollos 10,9 hónappal szemben).[17]
Egy placebókontrollos kettős vak, randomizált, kontrollált, fázis III. vizsgálat 2009 áprilisában kezdődött olyan kasztrációrezisztens prosztatarákban szenvedő betegeken, akik előzőleg nem részesültek kemoterápiás kezelésben.[18][19] A vizsgálatban résztvevő 1088 férfi abirateron-acetátot (1000 mg napi dózisban) és prednizont (5 mg napi dózisban), illetve placebót és prednizont kapott. A progressziómentes túlélési ráta 16,5 hónap volt az abirateron-acetát/prednizon kezelés esetén, míg a prednizon kezelés során 8,3 hónap (kockázati hányados (HR) = 0,53, 95%-os konfidenciaintervallum (CI), 0,45-től 0,62-ig, P<0,001). 22,2 hónapos utókezelést követően az általános túlélési ráta jobbnak bizonyult az abirateron-acetát/prednizon kezelés esetén a placebo/prednizonhoz képest (27,2 hónap), HR = 0,75, 95%-os CI, 0,61-tól 0.93-ig, P=0,01).[20]
Gyógyszerformák[szerkesztés]
Az abirateron-acetát 250 mg-os és 500 mg-os filmbevonatú és 250 mg-os bevonati nélküli tabletták formájában van forgalomban.[1] Javasolt napi dózisa 1000 mg naponta orálisan alkalmazva éhgyomorra, kasztrációval együtt, illetve napi 2×5 mg prednizonnal kombinálva.[1]
Kontraindikációk[szerkesztés]
A kontraindiációk közé tartozik az abirateron-acetátra való túlérzékenységi reakció. Terhes vagy terhesség előtt álló nőknek nem ajánlott az alkalmazása.[11][21] Terhes nőknek nem ajánlott a tabletták megérintése, csak megfelelő védőkesztyű viselete mellett.[21] Egyéb más ellenjavallatok: súlyos májkárosodás, hyperaldosteronizmus, szív-és érrendszeri betegségek beleértve szívelégtelenség, magas vérnyomás, hypokalaemia és mellékvese-elégtelenség.[22]
Mellékhatások[szerkesztés]
Mellékhatások előfordulási gyakorisága[1][11][12][13][22][szerkesztés]
Nagyon gyakori (gyakorisága >10%)[szerkesztés]
Gyakori (gyakorisága 1-10% közötti)[szerkesztés]
- Hypertriglyceridaemia
- Szepszis (vérmérgezés)
- Szívelégtelenség
- Angina pectoris
- Szívritmuszavar
- Pitvarfibrilláció
- Tahikardia
- Dyspepsia
- Kiütések
- Alanin-aminotranszferáz aktivitás növekedése
- Aszpartát-aminotranszferáz aktivitás növekedés
- Törések
- Vérvizelés (haematuria)
Nem gyakori (gyakorisága 0,1-1% közötti)[szerkesztés]
Nagyon ritka (gyakorisága <0,1%)[szerkesztés]
- Hiperszenzitív pneumonitisz (allergiás alveolitisz)
Túladagolás[szerkesztés]
Klinikai alkalmazása során túladagolási esetről nincs adat.[1] Nem létezik semmilyen antidótum (ellenanyag) abirateron-acetát túladagolással szemben, ugyanakkor a kezelés során szükséges néhány alapvető életfunkció nyomon követése, beleértve a szív és a májfunkció monitorozását.[1]
Interakciók[szerkesztés]
Az abirateron-acetát a CYP3A4 szubsztrátja, ezért nem ajánlott együtt alkalmazni CYP3A4 gátlókkal, mint amilyen a ketokonazol, itrakonazol, klaritromicin, atazanavir, nefadozon, szakinavir, telitromicin, ritonavir, indinavir, nelfinavir, verikonazol vagy CYP3A4-induktorokkal, mint a fenitoin, karbamazepin, rifampicin, rifabutin, rifapentin, fenobarbitál.[21][22] Ugyanakkor gátolja a CYP1A2, a CYP2C9 és a CYP3A4 enzimek működését is és ezért nem ajánlott egyidejűleg alkalmazni ezen enzimek olyan szubsztrátjaival, amelyeknek szűk a terápiás indexük.[21][22]
A spironolakton általában antiandrogén hatást fejt ki, viszont egyes vizsgálatokban kimutattak androgénreceptor-agonista hatást is androgénszegény környezetben, ezáltal indukálva a prosztatarákos sejtek proliferációját.[23] Ezt a megfigyelést számos egyéb tanulmány is alátámasztotta.[24] Ezért ajánlott a spironolakton alkalmazásának elkerülése azoknál a prosztatarákos betegeknél, akik az abirateron-acetát kezeléssel összefüggő mineralokortikoid okozta mellékhatásoktól szenvednek.
Farmakológia[szerkesztés]
Farmakodinamika[szerkesztés]
Antiandrogén aktivitás[szerkesztés]

Az abirateron-acetát aktív metabolitja az abirateron, amely gátolja a CYP17A1-t, amelynek két aktív formája is van, 17α-hidroxiláz (IC50 = 2,5 nM) és 17,20-liáz (IC50 = 15 nM), amely a herékben, mellékvesében, és a rákos prosztata szövetben is kifejeződik. A vegyület hatszor nagyobb szelektivitást mutat a 17α-hidroxilázzal, mint a 17,20-liázzal szemben. A CYP17A1 két egymást követő reakciót is katalizál: egyrészt (a) a pregnenolon és a progeszteron átalakítását 17α-hidroxi származékokká a 17α-hidroxiláz aktivitása révén, másrészt (b) az ezt követő dehidro-epiandroszteron (DHEA) és androszténdion keletkezését a 17,20-liáz aktivitása által.[25][26] A DHEA és az androszténdion, mint androgének, a tesztoszteronszintézis prekurzorai. A CYP17A1 aktivitásának gátlásával csökkenthető az androgének szintje, így a DHEA, a tesztoszteron, és a dihidro-tesztoszteroné (DHT). Az abirateron-acetát az aktív abirateron metabolitja révén képes csökkenteni a keringésben lévő tesztoszteronszintet 1 ng/dL alá a kasztráció során.[25][27] Így számottevően alacsonyabb koncentrációk érhetőek el, mint csak a kasztrációval (~20 ng/dL).[27] A kasztráció során alkalmazott abirateron-acetát a DHT szintjét 85%-kal, a DHEA-t 98-ról 97%-ra, és az androszténdion-t 78-ról 77%-ra csökkentette összehasonlítva a kasztrációval.[27] Az abirateron-acetát az antiandrogén aktivitásának köszönhetően csökkenti a prosztata és a herék tömegét.[28]
Az Abirateron az androgén receptor (AR) részleges antagonistája, illetve gátolja a 3β-hidroxi dehidrogenáz (3β-HSD), a CYP11B1 (szteroid 11β-hidroxiláz), a CYP21A2 (szteroid 21-hidroxiláz) és más CYP450 enzimek (pl. CYP1A2, CYP2C9 és a CYP3A4) működését.[22][29][30][31] Az abirateron aktivitásának nagy részét egy még erősebb aktivitást mutató metabolitnak, a ∆4-abirateronnak (D4A) köszönheti, amely az abirateronból keletkezik a 3β-HSD által.[32] A D4A ugyanakkor gátolja a CYP17A1, a 3β-hidroxiszteroid dehidrogenáz/∆5-4 izomeráz és az 5α-reduktáz enzimek aktivitását, illetve kompetitív antagonistája az AR receptornak hasonlóan, mint az enzalutamid.[32] Azonban a D4A kezdeti 5α-redukált metabolitja, a 3-keto-5α-abirateron az AR agonistája és elősegítheti a prosztatarák fejlődését.[33] A dutaszterid egy erős 5α-reduktáz gátló, így egyidejű alkalmazásával elkerülhető a 3-keto- 5α-abirateron keletkezése.[33] Ugyanakkor az abirateron egyes analógjait, mint például a galeteront szintén alkalmazzák metasztázisos nagy kockázatú kasztrációrezisztens prosztatarák mCSPC kezelésére, mivel ez a hatóanyag is hatásosan gátolja a CYP17A1 enzim működését.[34]
Ösztrogénaktivitás[szerkesztés]
Az abirateron-acetát azáltal, hogy képes csökkenteni az ösztrogénszintet, elvileg felhasználható lenne mellrák kezelésére.[35] Azonban az abirateron az ösztrogénreceptor direkt agonistája és in vitro vizsgálatokban a rákos sejtek proliferációját indukálta.[35] Az abirateron-acetátot ösztrogénreceptor-antagonistákkal (pl. fulvesztrán) együtt lehet mellrák kezelésére használni.[35] Annak ellenére, hogy antiandrogén és ösztrogén tulajdonságokkal rendelkezik, az abirateron-acetát nem okoz gynecomastiat.[36]
Egyéb aktivitás[szerkesztés]
Az abirateron-acetát azáltal, hogy gátolja a glükokortikoid bioszintézisét, mellékvese-elégtelenséget, hyperaldosteronizmust és az ezekkel járó mellékhatásokat okoz.[37] Ezért a kezelések során mindig prednizonnal és kortikoszteroidokkal együtt alkalmazzák, aminek elsősorban az a célja, hogy a glükokortikoidokat pótolják és megelőzzék a mineralokortikoid felesleget.[38]
Farmakokinetika[szerkesztés]
A szájon át történő alkalmazást követően az abirateron-acetát az aktív abirateron formává alakul. Ez az átalakulás inkább észteráz-, nem pedig CYP-mediált. Az élelmiszerrel történő bevitele növeli a hatóanyag felszívódását, ezért is ajánlott éhgyomorra, evés előtt egy órával vagy evést követően két órával alkalmazni. Az abirateron-acetát nagy affinitással kötődik fehérjékhez (>90%), metabolizációja inaktív metabolittá a májban megy végbe a CYP3A4 és a SULT2A1 révén. Kiválasztása egyrészt a széklettel (~88%) és a vizelettel (~5%) történik, felezési ideje 12±5 óra.[21]
Kémia[szerkesztés]
Az abirateron-acetát vagy más néven 17-(3-piridinil)-androszta-5,16-dien-3β-ol-acetát egy szintetikus androsztán szteroid, illetve egy androsztadienol (androszta-5,16-dien-3β-ol) származék, egy endogén androsztán feromon.[39] Az abirateron-acetát az abirateron C3β-acetát észtere.[40]
Történet[szerkesztés]
Az 1990-es évek elején Mike Jarman, Elaine Barrie és Gerry Potter a Londonban található Rákkutató Intézetben elkezdték új, a prosztatarák kezelésére alkalmas gyógyszerhatóanyagok fejlesztését. A nem-szteroid androgénszintézis-gátló ketokonazolt használták modellvegyületként, így állították elő az abirateront, amelyet 1993-ban szabadalmaztattak.[6][41] A hatóanyag forgalmazására a jogot a BTG kapta meg, amely az Egyesült Királyságban található egyik legnagyobb egészségügyi termékekre specializálódott vállalat. A BTG átadta a jogot a Cougar Biotechnology-nak, amely elkezdte a forgalomban levő hatóanyag fejlesztését.[42] 2009-ben a Johnson & Johnson megvásárolta a jogot a Cougartól a hatóanyag fejlesztésére és forgalmazására, illetve újabb klinikai vizsgálatokat indítottak, hogy növelhessék a gyógyszer klinikai felhasználási területét.[43]
2011 április 28-án az Amerikai Egyesült Államokban az FDA engedélyezte az abirateron-acetátot.[7][8] Egy fázis III. klinikai vizsgálatra hivatkozva, amelyben az abirateron használat 14,8 hónapos túlélési rátát mutat a 10,9 hónapos placebóval szemben.[17] Az abirateron-acetátot az Európai Gyógyszerügynökség is szintén jóváhagyta.[44] 2012 májusáig a National Institute for Health and Clinical Excellence (NICE) nem javasolta a hatóanyag használatát az NHS-nek a kedvezőtlen költséghatékonyság miatt. Az ár csökkentése után ezt az álláspontot megváltoztatták.[45] A hatóanyagot csak olyan férfiak kaphatják, akik már korábban részesültek legalább egyszer docetaxeltartalmú kemoterápiás kezelésben.[46][47] 2019 májusában az amerikai fellebbviteli bíróság jóváhagyta azt a szabadalmi vizsgálatot, amely alapján érvénytelenítették a Johnson & Johnson’s szabadalmi jogát a Zytiga prosztatarák-ellenes hatóanyag forgalmazására.[48]
Generikus nevek[szerkesztés]
A hatóanyag generikus gyógyszerneve abirateron-acetát, míg a deacetilált formáé az abirateron.[10]
Márkanevek[szerkesztés]
Az abirateron-acetát forgalomba hozatalának joga jelenleg Janssen Biotech (a Johnson & Jonhson’s leányvállalata) kezében van Zytiga márkanéven.[10] Ugyanakkor az Intas Pharmaceuticals Abirata néven, a Cadila Pharmaceuticals Abreton néven, míg a Glenmark Pharmaceuticals Abirapro néven forgalmazza a hatóanyagot. A Sun Pharmaceuticals Industries Yonsa néven hozta forgalomba.[5]
Forgalmazás[szerkesztés]
Az abirateron-acetát számos országban forgalomban van, így az Amerikai Egyesült Államokban, Kanadában, az Egyesült Királyságban. Írországban és más európai országokban is, valamint Ausztráliában, Új-Zélandon, a latin-amerikai országokban és Izraelben is.[10]
Kutatás[szerkesztés]
Az abirateron-acetáttal jelenleg is számos kutatás zajlik, többek között vizsgálják mellrák és petefészekrák kezelésében, ezzel kapcsolatban 2018 márciusa óta zajlik egy fázis II. klinikai vizsgálat.[49] Ugyanakkor vizsgálják veleszületett mellékvesekéreg-hyperplasia kezelésére is, viszont jelenleg még több információra van szükség ezen a területen való potenciális alkalmazhatóságát tekintve.[49] Egy megnövelt biohasznosulású, szájon át alkalmazható, abirateron-acetát nanorészecskéket tartalmazó tablettával vizsgálatok folynak a dózis csökkentése érdekében.[50]
Hivatkozások[szerkesztés]
- ↑ a b c d e f g h i j k l m n o p q Zytiga- abiraterone acetate tablet, film coated. DailyMed , 2019. június 13. (Hozzáférés: 2021. február 19.)
- ↑ a b c d (2016. november 1.) „Pharmacokinetic Aspects of the Two Novel Oral Drugs Used for Metastatic Castration-Resistant Prostate Cancer: Abiraterone Acetate and Enzalutamide”. Clin Pharmacokinet 55 (11), 1369–1380. o. DOI:10.1007/s40262-016-0403-6. PMID 27106175.
- ↑ a b c d Meeting Library - Meeting Library. meetinglibrary.asco.org . [2016. szeptember 20-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ Potter et al. J. Med. Chem., 1995, 38 (13), pp 2463–2471
- ↑ a b Sun Pharma Gets FDA Go-Ahead for Yonsa for Prostate Cancer (amerikai angol nyelven). BioSpace. (Hozzáférés: 2019. június 28.)
- ↑ a b GA, Potter, Jarman (1995. április 25.). „Novel steroidal inhibitors of human cytochrome P45017 alpha (17 alpha-hydroxylase-C17,20-lyase): potential agents for the treatment of prostatic cancer.”. Journal of medicinal chemistry 38 (13), 2463–71. o. [2019. december 7-i dátummal az eredetiből archiválva]. ISSN 0022-2623. (Hozzáférés: 2019. július 1.)
- ↑ a b Drugs@FDA: FDA Approved Drug Products. www.accessdata.fda.gov. (Hozzáférés: 2019. június 28.)
- ↑ a b Archivált másolat. [2013. szeptember 22-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ Abiraterone Approval Expanded for Prostate Cancer (angol nyelven). National Cancer Institute, 2018. február 15. (Hozzáférés: 2019. június 28.)
- ↑ a b c d Abiraterone (angol nyelven). Drugs.com. (Hozzáférés: 2019. június 28.)
- ↑ a b c d https://www.ema.europa.eu/en/documents/product-information/zytiga-epar-product-information_en.pdf
- ↑ a b c Zytiga 250 mg tablets - Summary of Product Characteristics (SPC) - (eMC). web.archive.org, 2014. február 1. [2014. február 1-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ a b c https://www.ebs.tga.gov.au/ebs/picmi/picmirepository.nsf/pdf?OpenAgent&id=CP-2012-PI-01395-3
- ↑ Health, Australian Government Department of. „Pharmaceutical Benefits Scheme (PBS) |” (angol nyelven), Kiadó: Australian Government Department of Health.
- ↑ George, Saby, Edward (2015. július 1.). „Strategies to Circumvent Testosterone Surge and Disease Flare in Advanced Prostate Cancer: Emerging Treatment Paradigms” (amerikai angol nyelven). Journal of the National Comprehensive Cancer Network 13 (7), e49–e55. o. DOI:10.6004/jnccn.2015.0109. ISSN 1540-1405.
- ↑ Abiraterone Acetate in Castration-Resistant Prostate Cancer Previously Treated With Docetaxel-Based Chemotherapy - Full Text View - ClinicalTrials.gov (angol nyelven). clinicaltrials.gov. (Hozzáférés: 2019. július 1.)
- ↑ a b https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3471149/
- ↑ Abiraterone Acetate in Asymptomatic or Mildly Symptomatic Patients With Metastatic Castration-Resistant Prostate Cancer - Full Text View - ClinicalTrials.gov (angol nyelven). clinicaltrials.gov. (Hozzáférés: 2019. július 1.)
- ↑ Archivált másolat. [2018. április 15-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3683570/
- ↑ a b c d e Wayback Machine. web.archive.org, 2014. november 13. [2014. november 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ a b c d e Zytiga (abiraterone) dosing, indications, interactions, adverse effects, and more. reference.medscape.com. (Hozzáférés: 2019. július 1.)
- ↑ Luthy, I. A., F. (1988. november 1.). „Androgenic activity of synthetic progestins and spironolactone in androgen-sensitive mouse mammary carcinoma (Shionogi) cells in culture”. Journal of Steroid Biochemistry 31 (5), 845–852. o. DOI:10.1016/0022-4731(88)90295-6. ISSN 0022-4731.
- ↑ Dhondt, Bert, Jeroen Van (2018. november 26.). „Abiraterone and spironolactone in prostate cancer: a combination to avoid”. Acta Clinica Belgica 0 (0), 1–6. o. DOI:10.1080/17843286.2018.1543827. ISSN 1784-3286. PMID 30477405.
- ↑ a b Stephen Neidle: Cancer Drug Design and Discovery. 2013–09–30. ISBN 9780123972286 Hozzáférés: 2019. július 1.
- ↑ Pandey, Amit V., Núria (2018/6). „Mechanism of the Dual Activities of Human CYP17A1 and Binding to Anti-Prostate Cancer Drug Abiraterone Revealed by a Novel V366M Mutation Causing 17,20 Lyase Deficiency” (angol nyelven). Pharmaceuticals 11 (2), 37. o. DOI:10.3390/ph11020037.
- ↑ a b c Small, Eric J. (2014. október 13.). „Can Targeting the Androgen Receptor in Localized Prostate Cancer Provide Insights Into Why Men With Metastatic Castration-Resistant Prostate Cancer Die?”. Journal of Clinical Oncology 32 (33), 3689–3691. o. DOI:10.1200/JCO.2014.57.8534. ISSN 0732-183X.
- ↑ Donald Tindall – James Mohler: Androgen Action in Prostate Cancer. 2009–04–20. ISBN 9780387691794 Hozzáférés: 2019. július 1.
- ↑ Qingzhong Hu (2014. január 1.). „CYP17 inhibitors—abiraterone, C17,20-lyase inhibitors and multi-targeting agents” (angol nyelven). Nature Reviews Urology 11 (1), 32–42. o. DOI:10.1038/nrurol.2013.274. ISSN 1759-4820.
- ↑ Malikova, Jana, Sameer S. (2017. november 1.). „CYP17A1 inhibitor abiraterone, an anti-prostate cancer drug, also inhibits the 21-hydroxylase activity of CYP21A2”. The Journal of Steroid Biochemistry and Molecular Biology 174, 192–200. o. DOI:10.1016/j.jsbmb.2017.09.007. ISSN 0960-0760.
- ↑ Udhane, Sameer S., Qingzhong (2016. szeptember 2.). „Specificity of anti-prostate cancer CYP17A1 inhibitors on androgen biosynthesis”. Biochemical and Biophysical Research Communications 477 (4), 1005–1010. o. DOI:10.1016/j.bbrc.2016.07.019. ISSN 0006-291X.
- ↑ a b https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4506215/
- ↑ a b https://dash.harvard.edu/bitstream/handle/1/29626087/5111629.pdf?sequence=1
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/15828836
- ↑ a b c Capper, Cameron P., Matthew J. (2016. május 1.). „The CYP17A1 inhibitor abiraterone exhibits estrogen receptor agonist activity in breast cancer” (angol nyelven). Breast Cancer Research and Treatment 157 (1), 23–30. o. DOI:10.1007/s10549-016-3774-3. ISSN 1573-7217.
- ↑ Cortesi, Enrico, Antonio (2013. április 25.). „Multimodality Treatment of Gynecomastia in Patients Receiving Antiandrogen Therapy for Prostate Cancer in the Era of Abiraterone Acetate and New Antiandrogen Molecules” (english nyelven). Oncology 84 (2), 92–99. o. DOI:10.1159/000343821. ISSN 0030-2414. PMID 23128186.
- ↑ William D. Figg – Cindy H. Chau – Eric J. Small: Drug Management of Prostate Cancer. 2010–09–14. ISBN 9781603278294 Hozzáférés: 2019. július 1.
- ↑ Laura Rosenthal – Jacqueline Burchum: Lehne's Pharmacotherapeutics for Advanced Practice Providers - E-Book. 2017–02–17. ISBN 9780323447799 Hozzáférés: 2019. július 1.
- ↑ Potter, Gerard A., Michael (1995. június 1.). „Novel Steroidal Inhibitors of Human Cytochrome P45017.alpha.-Hydroxylase-C17,20-lyase): Potential Agents for the Treatment of Prostatic Cancer”. Journal of Medicinal Chemistry 38 (13), 2463–2471. o. DOI:10.1021/jm00013a022. ISSN 0022-2623.
- ↑ https://kopernio.com/viewer?doi=10.1021/acs.jmedchem.8b00419&route=6[halott link]
- ↑ Abiraterone: a story of scientific innovation and commercial partnership - The Institute of Cancer Research, London. www.icr.ac.uk. (Hozzáférés: 2019. július 1.)
- ↑ Cougar Biotechnology, Inc.. web.archive.org, 2008. szeptember 7. [2008. szeptember 7-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ Cougar Biotechnology, Inc.. web.archive.org, 2009. május 29. [2009. május 29-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ Anonymous: Zytiga (angol nyelven). European Medicines Agency, 2018. szeptember 17. (Hozzáférés: 2019. július 1.)
- ↑ Wayback Machine. web.archive.org, 2013. február 19. [2013. február 19-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. július 1.)
- ↑ 1 Guidance | Abiraterone for castration-resistant metastatic prostate cancer previously treated with a docetaxel-containing regimen | Guidance | NICE. www.nice.org.uk. (Hozzáférés: 2019. július 1.)
- ↑ NICE appraisal of earlier treatment with abiraterone for prostate cancer | Press and media | News. NICE. (Hozzáférés: 2019. július 1.)
- ↑ Fed. Circ. Backs PTAB Ax Of J&J Prostate Cancer Drug Patent - Law360 (angol nyelven). www.law360.com. (Hozzáférés: 2019. július 1.)
- ↑ a b Abiraterone acetate - Johnson & Johnson - AdisInsight. adisinsight.springer.com. (Hozzáférés: 2019. július 1.)
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5488144/
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az Abiraterone acetate című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
