Tioaldehidek

A tioaldehidek a szerves vegyületek közé tartozó, tioaldehid funkciós csoportot tartalmazó vegyületek, az aldehidek kéntartalmú megfelelőik: bennük az aldehidek oxigénatomját kénatom helyettesíti. Képletük RC(S)H, ahol R alkil- vagy arilcsoport. A tioaldehidek általában instabilak – például a tioformaldehid (H2C=S) ciklikus trimerré, 1,3,5-tritiánná kondenzálódik.[1] Kellő mértékű sztérikus zsúfoltság esetén stabil tioaldehidek is izolálhatók.[2]
Korábban a tioaldehidek létezésére csapdázási folyamatok alapján következtettek. Például feltételezték, hogy az Fc2P2S4 és benzaldehid reakciójában tiobenzaldehid keletkezik, mely a tiotiofoszfinilidekkel cikloadduktumot, C2PS3 gyűrűt képez.[3]
Jellemzők[szerkesztés]
A tialok könnyen trimerizálódnak 1,3,5-tritiánokká. Például az etántial trimerje előfordulhat α- vagy β-formában:[4]
| A tritiánok izomériája (itt 2,4,6-trimeihl-1,3,5-tritián) | |
|---|---|
 α-forma |
 β-forma |
Az α- és β-forma tautomériáját katalizátorok, például jód, kénsav, sósav vagy savkloridok elősegíthetik. Aromás tialok kevésbé trimerizálódnak.[5]

A tialok stabilizációja lehet sztérikus nagy csoportokkal (kinetikus stabilizáció), mint a 2,4,6-tri-terc-butiltiobenzaldehid esetén. Ez nagy csoportjai miatt nem tri- vagy polimerizálódik. További lehetőség a termodinamikai stabilizáció megfelelő szubsztituensekkel, például aminokkal, alkoholátokkal vagy vinilcsoportokkal (vinilógiaelv), mely a mezomer stabilitást növeli, így a vegyület kevésbé instabil. A termodinamikailag stabil tialok különösen stabilak és izolálhatók. A stabil alifás tialok általában rózsaszínek, és kristályosan vagy olajként találhatók meg. A stabil aromás tialok lilák, sötétkékek vagy zöldek lehetnek, és általában kristályosak.[6]
Szintézis[szerkesztés]
A tialok szintézise a tiokarbonil-csoporthoz kapcsolódó hidrogén miatt nehéz.[6] Ismertek azonban szintézisutak. Gyakori módszer a tritiánok pirolízise. Az 1,3,5-tritián pirolízise például tioformaldehidet ad:[7][8]
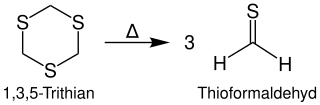
Az ekkor keletkező tialok új tritiánokká alakulhatnak. Ennek megfelelően a különbözőképp szubsztituált tritiánok különbözőképp szubsztituált termékeket adnak. Használatos még az acetaldehid vagy más aldehid trimetilszilil-csoporttal szubsztituált kénnel és butillítiummal való átrendezése, mely a megfelelő tialt adja.[6] Hasonló reakció mehet végbe kobalt(II)-kloridal.[6]

Az ekkor keletkező tialok instabilak. Létüket a ciklopentadiénnel ehhez kapcsolódó Diels–Alder-reakcióval igazolható. A tialok bekerülése Diels–Alder-adduktumokba használatos eljárás, mivel e cikloaddíciók gyakran reverzibilisek.[9] A tialok általában reakcióképes dienofilek az 1,3-diénekkel Diels–Alder-reakciókban.[5][10] Ezek lehetnek intramolekulárisak is.[11] Ez fotometrikusan generált tialokkal polimerfelszíneken is lehetséges.[12][13] Előállíthatók tialok allil-tioéterek pirolízisével is.[14][7]

Reakciók[szerkesztés]
A tialok reakciói a nukleofilekkel az aldehidekhez hasonlók.[14] Instabilitásuk miatt korlátozott reakcióképességük gyakran tri-, oligo- és polimereket ad.[7][15]

A tialok oxidációja 3-klórperbenzoesavval szulfinokat ad. Nátrium-borohidriddel vagy lítium-alumínium-hidriddel való redukciójuk tiolokat ad.[6][16] További reakcióik is ismertek.[17][18]
Hivatkozások[szerkesztés]
- ↑ H. W. Kroto, B. M. Landsberg, R. J. Suffolk, A. Vodden (1974). „The photoelectron and microwave spectra of the unstable species thioacetaldehyde, CH3CHS, and thioacetone, (CH3)2CS”. Chem. Phys. Lett. 29 (2), 265–269. o. DOI:10.1016/0009-2614(74)85029-3.
- ↑ N. Takeda, N. Tokitoh, R. Okazaki (1997). „Synthesis, Structure, and Reactions of the First Rotational Isomers of Stable Thiobenzaldehydes, 2,4,6-Tris[bis(trimethylsilyl)methyl]thiobenzaldehydes”. Chem. Eur. J. 3, 62–69. o. DOI:10.1002/chem.19970030111.
- ↑ A. Capperucci, A. Degl’Innocenti, P. Scafato, P. Spagnolo (1995). „Synthetic Applications of Bis(trimethylsilyl)sulfide: Part II. Synthesis of Aromatic and Heteroaromatic o-Azido-Thioaldehydes”. Chemistry Letters 24, 147. o. DOI:10.1246/cl.1995.147.
- ↑ A. Schönberg, A. Wagner.szerk.: E. Müller: Methoden zur Herstellung und Umwandlung von Thioaldehyden und Thioketonen, Schwefel-, Selen-, Tellurverbindungen, Methoden der Organischen Chemie. Stuttgart: Thieme Verlag, 699–703. o. (1955)
- ↑ a b J. Voss.szerk.: D. Klamann: Thioaldehyde bzw. Thioketone, Organische Schwefel-Verbindungen, Methoden der Organischen Chemie. Stuttgart: Thieme Verlag, 188–194. o. (1985). ISBN 3-13-218104-8
- ↑ a b c d e R. Okazaki.szerk.: P. Page: Chemistry of Thioaldehydes, Organosulfur Chemistry. San Diego: Academic, 225–258. o. (1995)
- ↑ a b c Siegfried Hauptmann. Organische Chemie, 2, Leipzig: VEB Deutscher Verlag für Grundstoffindustrie, 389. o. (1985). ISBN 3-342-00280-8
- ↑ H. Morita (1997). „Formation of thioaldehyde intermediates by thermolysis of sulfoxides bearing some heteroaromatics”. The Journal of Organic Chemistry 62 (26), 9018–9023. o. DOI:10.1021/jo9700181.
- ↑ G. W. Kirby (1993). „Thioaldehydes in synthesis”. Phosphorus, Sulfur, and Silicon and the Related Elements 74 (1-4), 17–29. o. DOI:10.1080/10426509308038098.
- ↑ W. M. McGregor, D. C. Sherrington (1993). „Some Recent Synthetic Routes th Thioketones and Thioaldehydes”. Chemical Society Reviews 22 (3), 199–204. o. DOI:10.1039/CS9932200199.
- ↑ M. Segi et al. (1989). „Intramolecular Diels-Alder Reaction of Thioaldehydes”. Synthetic Communications 19 (13–14), 2431–2439. o. DOI:10.1080/00397918908052644.
- ↑ M. Glassner et al. (2013). „Polymer surface patterning via Diels-Alder trapping of photo-generated thioaldehydes”. Chemical Communications 49 (6), 633–635. o. DOI:10.1039/C2CC37651B.
- ↑ T. Pauloehrl et al. (2013). „Spatially controlled surface immobilization of nucleophiles via trapping of photo-generated thioaldehydes”. Chemical Science 4 (9), 3503–3507. o. DOI:10.1039/C3SC50815C.
- ↑ a b R. Kracher et al.. Perf bis Zy, Lexikon der Chemie, Jokers edition, Heidelberg: Spektrum Verlag, 338. o. (2007). ISBN 978-3-8274-1909-5
- ↑ V. A. E. Usov, L. V. Timokhina, M. G. Voronkov (1990). „The synthesis and properties of thioaldehydes”. Russian Chemical Reviews 59 (4), 378–395. o. DOI:10.1070/RC1990v059n04ABEH003531.
- ↑ G. Opitz (1967). „Sulfine und Sulfene - die S-Oxide und S,S-Dioxide der Thioaldehyde und Thioketone”. Angewandte Chemie 79 (4), 161–177. o. DOI:10.1002/ange.19670790402.
- ↑ K. Okuma (1990). „Recent Studies on the Reactions of Thioaldehydes and Thioketones”. Sulfur reports 23 (2), 209–241. o. DOI:10.1080/01961770208047971.
- ↑ G. Li et al. (2000). „On the behavior of α,β-unsaturated thioaldehydes and thioketones in the diels− alder reaction”. The Journal of Organic Chemistry 65 (20), 6601–6612. o. DOI:10.1021/jo000740q.
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben a Thial című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
- Ez a szócikk részben vagy egészben a Thioaldehyde című német Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
