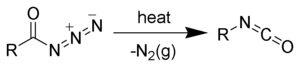Savazidok

A savazidok RCON3 általános képlettel leírható karbonsav-származékok.
Előállításuk[szerkesztés]
Alkil vagy aril savkloridok nátrium-azid vizes oldatával reagálva savaziddá alakulnak.[1][2]
Savazidok kitűnő hozammal, enyhe körülmények között szintetizálhatók számos karbonsavból és nátrium-azidból trifenilfoszfin és triklóracetonitril katalizátor jelenlétében.[3] Másik lehetőség alifás vagy aromás aldehidek jód-azidos reakciója, melyhez utóbbit nátrium-azid és jód-monoklorid acetonitriles reakciójában állítanak elő.[4]
Felhasználásuk[szerkesztés]
A savazidokat kémiai reagensként használják. A Curtius-lebontás során a savazidokból izocianátok keletkeznek.[5][6][7][8]
A Darapsky-lebontás során is keletkeznek savazidok:[9][10][11][12][13]
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az Acyl azide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások[szerkesztés]
- ↑ C. F. H. Allen and Alan Bell. „Undecyl isocyanate”. Org. Synth.. ; Coll. Vol. 3: 846
- ↑ Jon Munch-Petersen (1963). „m-Nitrobenzazide”. Org. Synth.. ; Coll. Vol. 4: 715
- ↑ (2008) „Direct Synthesis of Acyl Azides from Carboxylic Acids by the Combination of Trichloroacetonitrile, Triphenylphosphine and Sodium Azide”. Synlett. DOI:10.1055/s-2008-1077979.
- ↑ (2003) „Radical Azidonation of Aldehydes”. The Journal of Organic Chemistry 68 (24), 9453–5. o. DOI:10.1021/jo035163v. PMID 14629171.
- ↑ Curtius, T. (1890). „{{{title}}}”. Ber. 23, 3023. o.
- ↑ (1894) „20. Hydrazide und Azide organischer Säuren I. Abhandlung”. Journal für Praktische Chemie 50, 275. o. DOI:10.1002/prac.18940500125.
- ↑ Smith, P. A. S. (1946). „{{{title}}}”. Org. React. 3, 337–449. o.
- ↑ (1988) „Azides: Their preparation and synthetic uses”. Chemical Reviews 88 (2), 297. o. DOI:10.1021/cr00084a001.
- ↑ A. Darapsky (1936). „Darstellung von ?-Aminosäuren aus Alkyl-cyanessigsäuren”. J. Prakt. Chem. 146 (8–12), 250. o. DOI:10.1002/prac.19361460806.
- ↑ (1915) „Über das Hydrazid der Cyanessigsäure, Isonitrosocyanessigsäure und Nitrocyanessigsäure”. J. Prakt. Chem. 92, 297. o. DOI:10.1002/prac.19150920117.
- ↑ (1951) „Synthesis of Amino Acids from Substituted Cyanoacetic Esters”. Can. J. Chem. 29, 70. o. DOI:10.1139/v51-009.
- ↑ E. H. Rodd (1965). „Chemistry of Carbon Compounds”, New York, 1157. o.
- ↑ (1952) „Synthesis of α-Amino Acids from Ethyl Cyanoacetate”. Can. J. Chem. 30 (8), 592. o. DOI:10.1139/v52-071.