Etilén-diamin-tetraecetsav
| Etilén-diamin-tetraecetsav | |||

| |||
| |||
| IUPAC-név | N,N′-(etán-1,2-diil)bisz[N-(karboximetil)glicin][1] | ||
| Más nevek | H4EDTA diaminoetán-tetraecetsav etilén-dinitrilo-tetraecetsav VerseneTM | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 60-00-4 | ||
| ATC kód | V03AB03 | ||
| Gyógyszer szabadnév | edetates | ||
| Gyógyszerkönyvi név | Acidum edeticum | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C10H16N2O8 | ||
| Moláris tömeg | 292,25 g/mol | ||
| Sűrűség | 0,86 g/cm³ | ||
| Olvadáspont | 237–245 °C | ||
| Oldhatóság (vízben) | 0,5 g/l (25 °C) | ||
| Savasság (pKa) | pK1=0,0 (CO2H) (µ=1,0) pK2=1,5 (CO2H) (µ=0,1) pK3=2,00 (CO2H) (µ=0,1) pK4=2,69 (CO2H) (µ=0,1) pK5=6,13 (NH+) (µ=0,1) pK6=10,37 (NH+) (µ=0,1)[2] | ||
| Veszélyek | |||
| EU osztályozás | Irritatív (Xi)[3] | ||
| NFPA 704 | |||
| R mondatok | R36 [3] | ||
| S mondatok | (S2), S26[3] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
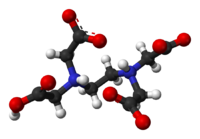
Az etilén-diamin-tetraecetsav (EDTA)[4] színtelen, vízben rosszul oldódó, erős kelátképző tulajdonságú, négyértékű poliamino-karbonsav.
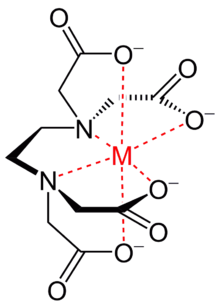
Ez a vegyület képes két- és háromértékű fémionokkal kelátkomplexet alkotni: a fémionokat a négy karboxilát- és két aminocsoportjával oktaéderes formájában köti meg. Különösen erős komplexet képez Mn(II), Cu(II), Fe(III), és Co(III) ionokkal.[5]
Előállítása[6][szerkesztés]
Egyik ipari előállítása hidrogén-cianidból, formaldehidből és etiléndiaminból történik Strecker-szintézissel. A keletkező tetranitrilt lúgos közegben hidrolizálják, a keletkező nátriumsót sósavval elbontják.
- H2NCH2CH2NH2 + 4 CH2O + 4 HCN → (NCCH2)2NCH2CH2N(CH2CN)2 + 4 H2O
Egy másik, egylépéses gyártás nátrium-cianidból, formaldehidből és etiléndiaminból indul ki, majd a keletkező nátriumsót szintén sósavval bontják el.
- H2NCH2CH2NH2 + 4 CH2O + 4 NaCN + 4 H2O → (NaO2CCH2)2NCH2CH2N(CH2CO2Na)2 + 4 NH3
Iparilag főként a második eljárás használatos, az első módszerrel nagyon tiszta termék állítható elő. A sav mellett a következő sóit is jelentős mennyiségben állítják elő és forgalmazzák: dinátrium-etiléndiamin-tetraacetát (Na2H2EDTA, E386), tetranátrium-etíléndiamin-tetraacetát (Na4EDTA), kalcium-dinátrium-etiléndiamin-tetraacetát (CaNa2EDTA, E385).
Kimutatása és mennyiségi meghatározása[szerkesztés]
Biológiai mintákból történő kimutatásának és meghatározásának legérzékenyebb módszere a kiválasztott ionfolyamat követéses kapilláris elektroforézis–tömegspektrometria (rövidítve SRM–CE/MS), melynek emberi vérplazmából a kimutatási határa 7,3 ng/ml, meghatározási határa pedig 15 ng/ml.[7] Ehhez a módszerhez akár már ~7-8 nl mintamennyiség is elegendő.[7]
Alkoholt nem tartalmazó üdítőitalokban már 2,0 μg/ml mennyiségben is mérhető nagyteljesítményű folyadékkromatográfiás módszerrel.[8][9]
Felhasználása[szerkesztés]
Ipar[szerkesztés]
Ipari felhasználásai elsősorban a kelátképző tulajdonságán alapulnak, vizes oldatokban fémsók megkötésére használják.
- Textiliparban fémsó-szennyezések megkötésével színstabilitást fokoz valamint fehérítő fürdők stabilizátora.
Egészségügy[szerkesztés]
- Véranalízisben antikoagulációs hatása miatt alkalmazzák.
- Na2Ca-EDTA komplexet akut ólommérgezés esetén (vér 45 µg/dl fölötti ólomszintje) használják intravénás injekció révén (6 óránként 25 mg/ttkg 5 napig). A Pb2+-ionok a Ca2+-ionokkal kicserélődnek az ólom-EDTA nagyobb stabilitása révén. Az 5 napos kezelési időszakot nem célszerű túllépni, ugyanis 5 nap után a Zn2+-ionok is elkezdik kicserélni a Ca2+-ionokat, ami halálhoz vezethet.[forrás?]
Molekuláris biológiai kutatások[szerkesztés]
Felhasználják DNS-t bontó DNázok (dezoxiribonukleázok) gátlására DNS analízis során. A DNázok többsége aktivitáshoz Mg2+ iont igényel, amely az EDTA-val kelátot képez, így hozzáférhetetlenné válik számukra.
Veszélyei[szerkesztés]
Toxicitás[szerkesztés]
Akut toxicitása alacsony, LD50 értéke patkánynál 2,0–2,2 g/kg.[10] Laboratóriumi állatoknál citotoxicitást és gyenge genotoxikus hatást mutattak ki. Orálisan reprodukciós és fejlődési rendellenességeket okoz.[11] Ugyanez a tanulmány megállapította, hogy kozmetikumok topikális alkalmazása esetén, illetve aeroszol formájában belélegezve olyan alacsony kitettségi szintet okoz, hogy az az orális adagolásnál mért mérgező szint alá esik.
Környezetszennyezés[szerkesztés]
Széles körű és nagymennyiségű használata miatt mára perzisztens szerves szennyezőanyaggá vált.[12] Ennek oka a lebomlásában keresendő. Első lépésben etiléndiamin-triecetsavvá bomlik, amely következő lépésben diketopiperazin-származékká ciklizálódik. Ez a tényleges szennyezést okozó vegyület.
Lásd még[szerkesztés]
Kalcium-dinátrium-(etilén-diamin)-tetraacetát
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az Ethylenediaminetetraacetic acid című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek[szerkesztés]
- ↑ A cikkbeli eredeti név az IUPAC jelentésében szerepelt, de utóbb kiderült, hogy hibás Archiválva 2019. augusztus 1-i dátummal a Wayback Machine-ben.
- ↑ Harris, D.C. "Quantitative Chemical Analysis", 7th ed., W. H. Freeman and Compagny, New York, 2007
- ↑ a b c Etilén-diamin-tetraecetsav (ESIS)[halott link]
- ↑ 3.3 Komplexometria. In Burger Kálmán: Az analitikai kémia alapjai: Kémiai és műszeres elemzés. 5. Budapest: Semmelweis. 1999. 98. o. ISBN 9639214051
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Synthesis of EDTA
- ↑ a b Robin L. Sheppard, and Jack Henion (1997). „Determining EDTA in Blood” (angol nyelven) (– Scholar search). Analytical Chemistry 69 (15), 477A–480A. o. DOI:10.1021/ac971726p. PMID 9253241. (Hozzáférés: 2007. július 25.)
- ↑ S. Loyaux-Lawniczak, J. Douch, and P. Behra (1999). „Optimisation of the analytical detection of EDTA by HPLC in natural waters” (angol nyelven). Fresenius' J. Anal. Chem. 364 (8), 727–731. o. [2007. október 12-i dátummal az eredetiből archiválva]. DOI:10.1007/s002160051422. (Hozzáférés: 2007. július 25.)
- ↑ Carolina E. Cagnassoa, Laura B. López, Viviana G. Rodríguez and Mirta E. Valencia (2006. May). „Development and validation of a method for the determination of EDTA in non-alcoholic drinks by HPLC” (angol nyelven). Journal of Food Composition and Analysis 20 (3-4), 248. o. DOI:10.1016/j.jfca.2006.05.008. (Hozzáférés: 2007. július 25.)
- ↑ J. Roger Hart "Ethylenediaminetetraacetic Acid and Related Chelating Agents" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a10_095
- ↑ Lanigan RS and Yamarik TA (2002). „Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA”. Int J Toxicol. 21 Suppl 2, 95–142. o. DOI:10.1080/10915810290096522. PMID 12396676. (Hozzáférés: 2008. január 28.)
- ↑ Zhiwen Yuan, Jeanne M. VanBriesen "The Formation of Intermediates in EDTA and NTA Biodegradation" Environmental Engineering Science 2006, volume 23, pp. 533-544. doi:10.1089/ees.2006.23.533

