Acil nukleofil szubsztitúció
Az acil nukleofil szubsztitúció (SNAc) a karbonsav-származékok (acilvegyületek) és nukleofilek között végbemenő szubsztitúciós reakciók csoportja. A reakció során egy acilvegyület (savhalogenid, -anhidrid vagy észter) távozó csoportja helyébe nukleofil – például alkohol, amin vagy enolát – lép. A reakció terméke olyan karbonilvegyület, melyben az eredeti molekulában lévő távozó csoport helyett a nukleofil található. Ezzel a reakcióval változatos anyagok szintetizálhatóak, mivel az acilvegyületek sokféle nukleofillel reakcióba lépnek, és a reakció terméke függ az adott reakcióban részt vevő karbonsav-származéktól és magától a nukleofiltől is.
Reakciómechanizmus[szerkesztés]
A karbonilvegyületek nukleofilekkel addíciós mechanizmus szerint reagálnak: a nukleofil megtámadja a karbonil szénatomot, így egy tetraéderes köztitermék keletkezik. A reakció savas vagy lúgos körülmények között felgyorsítható: előbbi esetben a karbonil szén válik elektrofilebbé, a másik esetben a nukleofil válik anionosabbá, ezáltal reakcióképesebbé. A tetraéderes köztitermék – a pH-tól függően – alkohol vagy alkoxid lehet.
Az acilvegyületből keletkező tetraéderes köztitermékben a központi szénatomhoz egy olyan szubsztituens kapcsolódik, mely távozó csoporttá válhat. A köztitermék képződése után elbomlik, újra kialakul a karbonil C=O kötés, a távozó csoport pedig eliminációs reakcióval kilép a molekulából. E két lépcsős addíciós-eliminációs folyamat eredményeként a karbonilvegyületben a nukleofil úgy lép a távozó csoport helyébe, hogy a köztitermékben nem található karbonil funkció. Mindkét lépés megfordítható folyamat, ezért az acil nukleofil szubsztitúció egyensúlyi folyamat.[1] Az egyensúlyban a legjobb nukleofilt tartalmazó termék a kedvezményezettebb, ezért a távozó csoportnak viszonylag gyenge nukleofilnek kell lennie ahhoz, hogy a reakciót a gyakorlatban is hasznosítani lehessen.
Savkatalízis[szerkesztés]
Savas körülmények között az 1 acilvegyület karbonilcsoportja protonálódik, így a nukleofil támadásával szemben aktívabbá válik. A második lépésben a 2 protonált karbonilvegyületet megtámadja a H−Z nukleofil, kialakul a 3 tetraéderes köztitermék. A Z nukleofilről az X távozó csoportra történő protonvándorlással a 4 vegyület keletkezik, melyből a protonált H−X távozó csoport kilépésével az 5 protonált karbonilvegyület jön létre. A proton leadásával végül kialakul a szubsztitúció 6 végterméke. Mivel az utolsó lépésben egy proton leadása zajlik, az acil nukleofil szubsztitúciós reakciókat savkatalizáltnak tekintjük. Vegyük észre, hogy savas körülmények között a nukleofil jellemzően protonált (azaz Z− helyett H−Z) formában van jelen.
Bázikus körülmények[szerkesztés]
Bázikus körülmények között a (Nuc) nukleofil megtámadja az 1 karbonsavszármazék karbonilcsoportját, miközben a 2 tetraéderes alkoxid köztitermék keletkezik. Az intermedierből kilép az (X) távozó csoport, így keletkezik a 3 szubsztituált termék. Bár az acil nukleofil szubsztitúciót katalizálhatja bázis, ez csak akkor lehetséges, ha a távozó csoport a nukleofilnél erősebb bázis. A savkatalizált folyamattal szemben bázikus körülmények között mind a nukleofil, mint a távozó csoport anionos formában van jelen.
Ezt a reakciómechanizmust izotópos nyomjelzéses kísérletekkel is megerősítették. Ha az etoxicsoportban oxigén-18-cal jelzett etil-propionátot nátrium-hidroxiddal (NaOH) kezelnek, a keletkező propionsavban nem mutatható ki oxigén-18, kizárólag az etanolban.[2]
Reaktivitási trendek[szerkesztés]
A karbonsav-származékoknak öt fő típusa van. A nukleofilekkel szemben a legreakcióképesebbek a savhalogenidek, ezeket követik a savanhidridek, az észterek és az amidok. A karboxilátionok – mivel nincs távozó csoportjuk – gyakorlatilag nem vihetők nukleofil szubsztitúciós reakcióba. Érdemes megjegyezni, hogy ezen vegyületek reakciókészsége rendkívül széles skálát fed le, a savkloridok reakciósebessége az amidokénak mintegy 1013-szorosa.[3]
A karbonsav-származékok reakcióképességének egyik fő meghatározója a távozó csoport „jósága”, mely összefüggésben van annak savasságával. A gyenge bázisok jobb távozó csoportok, mint az erős bázisok; az erős konjugált savval (pl. hidrogén-klorid) rendelkező részecskék jobb távozó csoportok, mint azok, melyek konjugált savja gyenge sav (pl. ecetsav). A kloridion ezért jobb távozó csoport, mint az acetátion. A karbonsav-származékok nukleofilekkel szembeni reakciókészsége a távozó csoport bázicitásának növekedésével csökken, amint az alábbi táblázat is mutatja.[4]
| vegyület neve | szerkezete | távozó csoport | a konjugált sav pKa-ja |
|---|---|---|---|
| acetil-klorid |  |
−7 | |
| ecetsav-anhidrid |  |
 |
4,76 |
| etil-acetát |  |
15,9 | |
| acetamid |  |
38 | |
| acetát anion |  |
nincs | – |

Az acilvegyületek reakciókészségének másik meghatározója a mezoméria. Az amidoknak két fő mezomer határszerkezete létezik, mindkettő nagymértékben hozzájárul a tényleges szerkezethez, így a karbonil szén és az amid nitrogénje közötti amidkötésnek jelentős kettős kötés karaktere van. Az amidkötés körüli rotáció energiagátja 75–85 kJ/mol (18–20 kcal/mol), jóval nagyobb, mint a szokásos egyszeres kötésekre jellemző érték: az etán C–C kötésénél az energiagát csak 12 kJ/mol (3 kcal/mol).[3] A nukleofil támadása után, amikor kialakul a tetraéderes köztitermék, az energetikailag kedvező mezomer effektus megszűnik. Ez segít megmagyarázni, miért az amidok az egyik legkevésbé reakcióképes acilvegyületek.[4]
Az észterekben a mezomer stabilizáló hatás gyengébb, mint az amidoknál, ezért a tetraéderes intermedier keletkezése és így a mezoméria megszűnése energetikailag nem annyira kedvezőtlen. Az anhidrideknél még kisebb mértékű a mezoméria stabilizáció, mert a mezoméria két karbonilcsoport között oszlik meg, így ezek a vegyületek az amidoknál és az észtereknél reakcióképesebbek. A savhalogenidekben csak nagyon kis mértékű a mezomer effektus, így a tetraéderes köztitermék keletkezésének csak nagyon kicsi az energiaigény többlete. Mindezek segítenek megérteni azt, hogy miért a savhalogenidek a legreakcióképesebb karbonsav-származékok.[4]
A karbonsavszármazékok reakciói[szerkesztés]
Az acil nukleofil szubsztitúciós reakciókban gyakori, hogy egy karbonsavszármazék másféle karbonsavszármazékká alakul át. Általában a reakcióképesebb vegyületből keletkezik egy stabilabb, a savkloridok például könnyen észterré alakíthatóak, míg az észterekből közvetlenül savkloridot előállítani szinte lehetetlen. Az acilvegyületek egymásba alakítása során a termék mindig stabilabb lesz a kiindulási anyagnál.
Lehetséges olyan acil nukleofil szubsztitúciós reakció is, melyben nem karbonsav-származékok közötti átalakulás játszódik le. Az amidok és karbonsavak Grignard-reagenssel például ketonok keletkezése közben reagálnak. Alább összefoglaljuk, hogy az egyes karbonsav-származékok milyen reakciókban vehetnek részt.
Savhalogenidek[szerkesztés]
A savhalogenidek a legreakcióképesebb karbonsav-származékok, könnyen átalakíthatók bármely más származékká. Karbonsavakkal savanhidridek képződése közben reagálnak. Ha a sav és a savklorid szerkezete különböző, akkor vegyes anhidrid keletkezik. Az első lépésben a karbonsav megtámadja a(z 1) savkloridot, így alakul ki a 2 tetraéderes köztitermék, mely utána a kloridion kilépésével továbbalakul a 3-as oxóniumionná. Ebből protonleadás után kialakul a 4 vegyes savanhidrid, illetve egy ekvivalens HCl.
Az alkoholok és aminok savhalogenidekkel rendre észtereket és amidokat képeznek, ezt a reakciót Schotten–Baumann-acilezésnek is nevezik.[5] A savhalogenidek víz jelenlétében karbonsavvá hidrolizálnak, ez a reakció azonban csak kevéssé hasznos, mivel a savhalogenideket többnyire karbonsavakból állítják elő. A savhalogenidekkel végzett reakciók nagy részét – a melléktermékként keletkező hidrogén-halogenidet semlegesítendő – nem nukleofil sajátságú bázis, például piridin jelenlétében hajtják végre.
A savhalogenidek szén nukleofilekkel, például Grignard-reagenssel és enolátokkal is reagálnak, de ezek során különböző termékek keveréke is keletkezhet. Bár a szén nukleofilek a savhalogenidekkel első lépésben ketont adnak, maga a keton is érzékeny nukleofilek támadására, így tovább alakulhat tercier alkohollá. A(z 1) benzoil-klorid például két ekvivalens Grignard-reagenssel, például metil-magnézium-bromiddal (MeMgBr) kitűnő kitermeléssel (3) 2-fenil-2-propanol képződése közben reagál. Bár a reakció köztitermékeként (2) acetofenon is keletkezik, ezt nem lehet elkülöníteni, mivel a második ekvivalens MeMgBr hatására közvetlenül a képződése után gyorsan elreagál.[6]

A legtöbb szén nukleofiltől eltérően a lítium-dialkil-kuprátok – Gilman-reagens – csak egy ekvivalens mennyiségben reagálnak a savhalogenidekkel, így a reakció során keton keletkezik. Ez a reakció azonban nem acil nukleofil szubsztitúció, hanem feltehetően gyökös mechanizmus szerint játszódik le.[2] Savhalogenidek a Weinreb-féle ketonszintézissel is átalakíthatók ketonokká. E reakció során a savhalogenidet először N-metoxi-N-metillamiddá (Weinrab-amid) alakítják. Ha a Weireb amidra szén nukleofil – például Grignard-reagens vagy lítiumorganikus vegyület – addícionál, a fémion a karbonil és az N-metoxi oxigénatomokkal kelátot képez, ami megakadályozza a további nukleofil addíciós reakciót.[7]
A Friedel–Crafts-acilezés során a savhalogenidek mint elektrofilek vesznek részt az aromás elektrofil szubsztitúciós reakcióban. Ennek során a savhalogenid halogénjéhez egy Lewis-sav – például cin-klorid (ZnCl2), vas(III)-klorid (FeCl3) vagy alumínum-klorid (AlCl3) – koordinálódik, így a vegyület érzékenyebbé válik az aktivált aromás gyűrű nukleofil támadásával szemben. Elektronban különösen gazdag aromás gyűrűk esetén a reakció Lewis-sav nélkül is lejátszódik.[8]
Tioészterek[szerkesztés]
A tioészterek és savhalogenidek kémiája hasonló, előbbiek reakciókészsége a savkloridokéra emlékeztet, bár azokétól enyhébb.
Anhidridek[szerkesztés]
A savhalogenidek és -anhidridek kémiája hasonlít egymásra. Az anhidrideket nem lehet savhalogeniddé alakítani, de más karbonsav-származékok előállíthatók belőlük. Az anhidridek is részt vesznek a Schotten–Baumann típusú reakciókban, mellyel alkoholokból és aminokból észterek, illetve amidok nyerhetők. Vízzel hidrolizálva a megfelelő karbonsav keletkezik belőlük. A savhalogenidekhez hasonlóan az anhidridekből is készíthetők ketonok és/vagy tercier alkoholok szén nukleofilekkel történő reakcióban, és használhatók a Friedel–Crafts-acilezésben és a Weinreb-féle ketonszintézisben is.[8] A Gilman-reagenssel azonban – a savhalogenidekkel ellentétben – nem lépnek reakcióba.[2]
Az anhidridek reakciókészsége növelhető katalitikus mennyiségű N,N-dimetil-aminopiridin (DMAP) hozzáadásával. Piridin is használható, ennek is hasonló a hatásmechanizmusa.[5]
Első lépésben a 2 DMAP az 1 anhidridre támadással tetraéderes köztiterméket képez, melyből a karboxilátion kilépése után 3 amid keletkezik. Ez a köztes amid az eredeti anhidridnél érzékenyebb a nukleofil támadására, mert a dimetil-aminopiridin a karboxilátnál jobb távozó csoport. Az utolsó lépésekben a Nuc nukleofil a 3 támadásával másik tetraéderes köztiterméket hoz létre. Amikor a 4 termék keletkezik, a távozó piridincsoportban visszaáll az aromás rendszer, ami a reakciónak jelentős hajtóereje, és ez magyarázza, hogy a piridincsoport a karboxilátionnál jobb távozó csoport.
Észterek[szerkesztés]
Az észterek a savhalogenideknél és -anhidrideknél kevésbé reakcióképesek. Ammóniával, valamint primer és szekunder aminokkal reagálva amidokat képeznek, de ezt a reakciót ritkán használják, mert savhalogenidekkel jobb kitermelés érhető el. Az észterek átalakíthatók más észterekké, ezt az eljárást átészteresítésnek nevezik. Az átészteresítés során egy észter és alkohol reagál, melyet sav vagy bázis katalizál. Sajnos mivel a távozó csoport szintén alkohol, az oda- és visszaalakulás sebessége gyakran hasonló. A reaktáns alkohol nagy feleslegével vagy a kilépő alkohol (például desztillációval történő) eltávolításával a reakció teljessé tehető – a Le Chatelier-elvnek megfelelően.[9]
Az észterek savval katalizált hidrolízise is egyensúlyi folyamat – lényegében a Fischer-féle észteresítési reakció fordított folyamata. Mivel az alkohol (mely a távozó csoport szerepét tölti be) és a víz (mely nukleofilként szerepel) pKa értéke hasonló, a hidrolízis és az észterképzés egymással versengő reakció. Az átészteresítéshez hasonlóan itt is a reaktáns (víz) nagy feleslegével vagy a termék (alkohol) eltávolításával tehető teljessé a reakció.

Az észterek bázis katalizált hidrolízise – az úgynevezett elszappanosítás – nem egyensúlyi folyamat: a reakció ekvivalens mennyiségű bázist igényel, melynek révén egy ekvivalens alkohol és egy ekvivalens karboxilátsó keletkezik. A zsírsavak észtereinek elszappanosítása iparilag is jelentős folyamat, ezt használják a szappangyártás során.[9]
Az észterek szén nukleofilekkel változatos reakciókba léphetnek. Grignard-reagens feleslegével tercier alkoholt képeznek. Az észterek enolátokkal is reagálnak, a Claisen-kondenzáció során egy észter 1 enolátja támadja egy másik 2 észter karbonilcsoportját, így a 3 tetraéderes köztitermék keletkezik. Ebből az R'O− alkoxidion kilépése után alakul ki a 4 β-keto észter termék.

Vegyes vagy keresztezett Claisen-kondenzáció is lehetséges, ilyenkor az enolát és a nukleofil különböző észterek. Az intermolekuláris Claisen-kondenzációt Dieckmann-kondenzációnak nevezik, ennek során gyűrűs termék keletkezik (ciklizációs reakció). Az észterek keton és aldehid enolátokkal is kondenzációs reakcióba léphetnek, ekkor β-dikarbonil vegyületek keletkeznek.[10] Ennek egyik sajátos példája a Baker–Venkataraman-átrendeződés, melynek során egy aromás orto-aciloxi keton intramolekuláris acil nukleofil szubsztitúciós reakció, majd ezt követő átrendeződés révén aromás β-diketon termékké alakul.[11]
Amidok[szerkesztés]
Kis reakciókészségük miatt az amidok a többi karbonsavszármazékál jóval kevesebb nukleofil szubsztitúciós reakcióban vesznek részt. Az amidok vízzel szemben stabilak, a hidrolízissel szemben mintegy 100-szor ellenállóbbak, mint az észterek.[3] Sav vagy bázis jelenlétében azonban karbonsavvá hidrolizálhatók. Az amidkötés stabilitásának biológiai következményei is vannak, hiszen a fehérjéket felépítő aminosavak amidkötésekkel kapcsolódnak egymáshoz. Az amidkötés kellően stabil a hidrolízissel szemben ahhoz, hogy a fehérjék vizes környezeteben is képesek megtartani alakjukat és szerkezetüket, de kellően érzékeny is, hogy szükség esetén fel lehessen szakítani.[3]
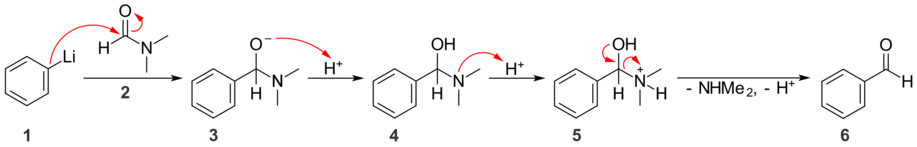
A primer és szekunder amidok nem reagálnak szén nukleofilekkel, velük szemben a Grignard-reagens és a lítiumorganikus vegyületek bázisként és nem nukleofilként viselkednek, és csak deprotonálják az amidot. A tercier amidok esetén nem áll fenn ez a probléma, szén nukleofilekkel ketonok képződése közben reagálnak. Az amidion (NR2−) nagyon erős bázis, tehát nagyon rossz távozó csoport, ezért az amidokon a nukleofil támadás csak egyszer játszódik le. Szén nukleofilekkel történő reakcióban N,N-dimetil-formamid (DMF) használható formilcsoport bevitelére.[12]
A fenti reakcióban az 1 fenillítium a 2 DMF karbonilcsoportján támad, kialakul a 3 tetraéderes köztitermék. Mivel a dimetilamid anion rossz távozó csoport, a köztitermék nem alakul tovább, így nincs lehetőség további nukleofil addícióra. Savas feldolgozás során az alkoxidion protonálásával 4, majd az amin protonálásával 5 keletkezik. Semleges dimetil-amin molekula kilépésével, majd protonleadással keletkezik a 6 benzaldehid.
Karbonsavak[szerkesztés]
A karbonsavak bár átalakíthatók más acilszármazékokká, nem különösebben reakcióképesek nukleofil szubsztitúcióban. A karbonsavak amiddá konvertálhatók, de ez a reakció nem megy könnyen végbe. Az aminok karbonsav jelenlétében nem nukleofilként, hanem bázisként reagálnak, így ammónium-karboxilát só keletkezik. A sót 100 °C fölé hevítve a víz elűzhető a rendszerből, ami az amid keletkezéséhez vezet. Az amidoknak ez az előállítási módja iparilag jelentős, de laboratóriumi felhasználásai is vannak.[13] Erős sav kataliátor jelenlétében a karbonsavak kondenzációs reakcióban savanhidridet képezhetnek. A reakció során ugyanakkor víz keletkezik, mely az anhidridet visszalakíthatja a kiindulási karbonsavakká, azaz az anhidridek kondenzációval történő képződése egyensúlyi folyamat.
Savkatalízis hatására a karbonsavak alkoholokkal észtereket képeznek a Fischer-féle észteresítési reakcióban. Ez utóbbi is egyensúlyi reakció. A karbonsavak észterré alakításának alternatív eljárása a diazometános reakció. Bár utóbbi gyakran kvantitatív kitermeléssel jár, csak metil-észterek képzésére használható.[13]
Tionil-kloriddal a karbonsavak a megfelelő savkloriddá alakíthatók. Első lépésben az 1 karbonsav megtámadja a tionil-kloridot, és kilép egy kloridion. A keletkező 2 oxóniumion nukleofil támadással szemben aktiválva van, és – a normál karbonsavaktól eltérően – egy jól távozó csoporttal is rendelkezik. A következő lépésben a 2-t megtámadja a kloridion, így a 3 klórszulfit tetraéderes köztitermék képződik. Ebből kén-dioxid és kloridion kilépéssel a 4 protonált savklorid keletkezik. A kloridion el tudja távolítani a karbonilcsoport protonját, így az 5 savklorid és egy HCl molekula keletkezik.
A foszfor(III)-klorid (PCl3) és a foszfor(V)-klorid (PCl5) is – hasonló mechanizmussal – savkloriddá alakítja a karbonsavakat. Egy ekvivalens PCl3 háromszoros mennyiségű savval reagál, a kívánt savklorid mellett egy ekvivalens foszforossav (H3PO3) keletkezése közben. A PCl5 1:1 arányban reagál a karbonsavakkal, melléktermékként foszforil-klorid (más néven foszfor(V)-oxiklorid, POCl3) keletkezik.
A karbonsavak Grignard-reagenssel és lítiumorganikus vegyületekkel ketonok keletkezése közben reagálnak. Az első ekvivalens nukleofil bázisként deprotonálja a savat, a második ekvivalens a karbonil szén támadásával geminális alkoxid dianiont hoz létre, melyből a feldolgozás során protonálódással a keton hidrátja keletkezik. Mivel a legtöbb keton hidrátja instabilabb a ketonhoz képest, a köztük fennálló egyensúly erősen a keton felé van eltolva. Az aceton-hidrát acetonból történő keletkezésének egyensúlyi állandója például csak 0,002.[14]
Hivatkozások[szerkesztés]
- ↑ Wade 2010, pp. 996–997.
- ↑ a b c McMurry, John. Organic Chemistry, 4th, Pacifc Grove, CA: Brooks/Cole Publishing Company, 820–821. o. (1996). ISBN 0534238327
- ↑ a b c d Carey, Francis A.. Organic Chemistry, 6th, New York: McGraw-Hill, 866–868. o. (2006). ISBN 0072828374
- ↑ a b c Wade 2010, pp. 998–999.
- ↑ a b Kürti, László. Strategic Applications of Named Reactions in Organic Synthesis. London: Elsevier Academic Press, 398. o. (2005). ISBN 0124297854
- ↑ McMurry 1996, pp. 826–827.
- ↑ Kürti and Czakó 2005, p. 478.
- ↑ a b Kürti and Czakó 2005, p. 176.
- ↑ a b Wade 2010, pp. 1005–1009.
- ↑ Carey 2006, pp. 919–924.
- ↑ Kürti and Czakó 2005, p. 30.
- ↑ Comprehensive Organic Functional Group Transformations, 1st, Oxford: Pergamon Press, 90. o. (1995). ISBN 0080423248
- ↑ a b Wade 2010, pp. 964–965.
- ↑ Wade 2010, p. 838.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Nucleophilic acyl substitution című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Külső hivatkozások[szerkesztés]
- Ecetsav-anhidrid reakciója acetonnal, Organic Syntheses Coll. Vol. 3, p. 16; Vol. 20, p. 6 Article