Hasnyálmirigyrák
| Hasnyálmirigyrák Pancreas carcinoma | |
 | |
| A hasnyálmirigy fejéből származó hám eredetű rosszindulatú daganat (adenokarcinóma) makroszkópos képe. Jól kivehető a vékonybélszakasz mellett elhelyezkedő, sárgás, ökölnyi nagyságú kóros szövetszaporulat | |
 | |
| Hasnyálmirigy-adenokarcinóma szövettani képe | |
| Szinonimák | A hasnyálmirigy malignus daganatai |
| Latinul | Carcinoma pancreatis |
| Angolul | Pancreatic cancer |
| Osztályozás | |
| BNO-9 | 157 |
| Leírás | |
| Érintett szervek | Az esetek 95%-ban a hasnyálmirigy kivezetőcsőrendszerének hámja |
| Kockázati tényezők | |
| Főbb tünetek | hasi fájdalom, sárgaság |
| OMIM | 260350 |
| DiseasesDB | 9510 |
| MedlinePlus | 000236 |
A Wikimédia Commons tartalmaz Hasnyálmirigyrák Pancreas carcinoma témájú médiaállományokat. | |
A hasnyálmirigyrák, vagy pankreász karcinóma (latinul: Carcinoma pancreatis) a hasnyálmirigy rosszindulatú (malignus) daganatos megbetegedése. Az Egyesült Államokban 2010-ben 43 140 új esetet diagnosztizáltak, amelyek közül 36 800 halállal végződött.[1] Az elváltozás rossz prognózisú, a diagnózis felállítását követően általában a betegeknek kevesebb mint 5%-a él öt évnél tovább.[2][3][4][5] A kórtünetek ideiglenes megszűnése, csökkenése, átmeneti javulás továbbra is extrém ritka[megj. 1][6] A hasnyálmirigy külső elválasztású mirigyállományából (exokrin hasnyálmirigy) kiinduló daganatok 95%-a a mirigyhámból kiinduló rák (ún. adenokarcinóma).[megj. 2][7] Az endokrin állományból kiinduló elváltozások ritkák, a szigetsejtes daganatok előfordulása kb. 1%.[8] A rákos halálozást okozó daganatok között a hasnyálmirigyrák Magyarországon az ötödik helyen áll, és az összes rákos halálozás közel 5%-át okozza.[9]
Járványtan[szerkesztés]

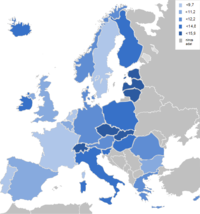
Annak ellenére, hogy a hasnyálmirigyrák relatíve ritka a többi emésztőrendszerből kiinduló daganatos megbetegedésekhez képest, az elváltozás a nyugati országokban a negyedik-ötödik helyet foglalja el a halállal végződő rákos megbetegedések listáján.[11] Világszerte a nyolcadik,[12][13] míg az Amerikai Egyesült Államokban a negyedik[14][15] helyen szerepel a férfiak és a nők körében egyaránt (a tüdő, a mell, a prosztata, a végbél és a petefészek daganatos elváltozásai után).

Évente átlagosan 230 000 új[16] esetet diagnosztizálnak világszerte, ebből 31 000[15][16]–42 470-et[1] az Egyesült Államokban. Az elváltozás előfordulása gyakoribb a nyugati típusú, iparosodott társadalmakban;[11] a betegeknek megközelítőleg 60%-a a fejlett, míg 40%-uk a fejlődő országokból kerül ki.[16] A rák magas halálozási arányszámmal (mortalitással)[megj. 3] bír a következő országokban: Dánia, Svédország, Finnország, Írország, Ausztria, Csehország, Szlovákia és Magyarország.[17] Ezzel szemben alacsony a halálozási arányszám Hongkongban, Spanyolországban, Görögországban, Portugáliában, a volt Jugoszlávia utódállamaiban, Indiában, Kuvaitban és Szingapúrban.[17] 1992-ben ~28 000,[18] 2005-ben ~29 000[19]– ~30 000,[20] míg 2010-ben mindezidáig ~36 800[1] amerikai állampolgár halálozott el ebben a betegségben. A hasnyálmirigyrák évente Európában átlagosan 40 000,[21][22] Japánban pedig 19 000[23] ember halálát okozza. Ezzel a számmal a halállal végződő összes rákos megbetegedések 5%-áért, míg az emésztő szervrendszerből kiinduló, szintén halállal végződő rákos megbetegedések 22%-áért tehető felelőssé.[18] Aggasztó tény, hogy a rák előfordulási gyakoriságának mértéke (100 000 főből 12 beteg) 1930-tól a duplájára emelkedett – különösen a női populáció körében.[19] A betegek 80%-a 60 és 80 év közötti.[11][19][24] A nyolcvanadik életévüket betöltő személyek 40-szer nagyobb valószínűséggel lesznek hasnyálmirigyrákosak, mint a negyedik évtizedükben járó embertársaik. Gyakrabban fordul elő férfiakban, mint nőkben (2:1),[25] illetve gyakoribb afroamerikaiakban,[11][25] új-zélandi maorikban, valamint az őslakos hawaiiakban.[11]
|
Klinikai megjelenés[szerkesztés]
A hasnyálmirigy csatornáiból kiinduló daganatos elváltozások[megj. 4] a hasnyálmirigy exokrin állományából kiinduló daganatok 90%-át teszik ki. Az elváltozások az esetek 67%-ában a hasnyálmirigy fejében alakulnak ki, és a diagnózis időpontjában már 2 centiméteres méreteket öltenek, amelyek a sebészi beavatkozás idején elérhetik az akár 2,5–3,5 cm-es nagyságot is. Méretüknél fogva összenyomhatják a hasnyálmirigy vezetékét, a közös epevezetéket (sárgaságot eredményezve), vagy akár a patkóbelet is, vérzést és bélelzáródást okozva. A hasnyálmirigy testében és farkában kialakuló elváltozások kevesebb tünettel járnak (mivel távolabb helyezkednek el a közös epevezetéktől). Felfedezésük időpontjában nagyobb méretűek (6–7 cm), előrehaladott szövettani jellegeket mutatnak és műtétileg nem kezelhetők, nem távolíthatók el (nem rezekálhatóak).[15]
A legtöbb esetben a diagnózis felállításakor a betegség már előrehaladott állapotban van (70–80%-ban áttétes), és mindössze a páciensek 15–20%-a alkalmas sebészi beavatkozásra. Habár a távoli áttétképzés lehetséges, az elváltozás leggyakrabban a környező struktúrákat (máj anatómiája, gyomor, patkóbél, vastagbél, májkapugyűjtőér, bélfodri artériák[megj. 5]) szűri be. Az 5 éves túlélés esélye továbbra is alacsony: 3–5%[15] (3% [1983–1985], 4% [1998–2002][20]). Diagnosztizálása után a betegek jelentős hányada egy éven belül elhalálozik ennél a ráktípusnál, miközben csupán 1 százalékuk marad életben tíz évvel a betegség kimutatása után.[27]

A hasnyálmirigyrákot „néma gyilkosnak” is nevezik, mivel a korai elváltozás tünetszegény,[28] és a későbbi tünetek az esetek többségében nem specifikusak.[28][29] Ennek következtében a rákos elfajulást nehéz diagnosztizálni, a diagnózis szinte mindig késői, áttétes állapotban születik meg.[28]
Lehetséges tünetek és jelek[szerkesztés]
- Övszerű felhasi fájdalom[4][28] az esetek 73–74%-ban.[30][31]
- Jelentős (látszólag indokolatlan) fogyás[4] az esetek 60–74%-ában.[30][31]
- Az étvágy csökkenése, anorexia[4][28] az esetek 70%-ában.[30][31]
- Fájdalmatlan, mélyülő icterus (sárgaság),[4][28] az esetek 65–72%-ában.[30][31]
- Hasmenés[4] az esetek 27%-ában.[30][31]
- Gyengeség[4] az esetek 21%-ában.[30][31]
- Tapintható epehólyag az esetek 9%-ában.[30][31]
- Székrekedés[4] az esetek 8%-ában.[30][31]
- Melena (szurokszéklet, vérszékelés)[4] az esetek 7%-ában.[30][31]
- Hematemezis (vérhányás)[4] az esetek 7%-ában.[30][31]
- Hányinger/hányás[4] az esetek 6%-ában.[30][31] májkapugyűjtőér
- Migráló thromphlebitis (Trousseau-jel/tünet)[megj. 6][4] az esetek <1%-ában.[30][31]
- Sötét vizelet[4][28]
- Zsírszéklet (Steatorrhea)[28]
Abnormális laboratóriumi eredmények[szerkesztés]
- Emelkedett alkalikus foszfatáz szint[4] az esetek 82%-ában.[32]
- Emelkedett 5'-nukleotidáz[megj. 7] szint[4] az esetek 71%-ában.[32]
- Emelkedett LDH[megj. 8]-szint[4] az esetek 69%-ában.[32]
- Emelkedett AST[megj. 9]-szint[4] az esetek 64%-ában.[32]
- Emelkedett bilirubinszint[4] az esetek 55%-ában.[32]
- Emelkedett amilázszint[4] az esetek 17%-ában.[32]
- Emelkedett Alfa-foetoprotein[megj. 10] szint[4] az esetek 6%-ában.[32]
- Csökkent albuminszint[4] az esetek 60%-ában.[32]
Patológia[szerkesztés]

A hasnyálmirigyrák kialakulását elősegítő tényezők közül – mint kórokozó tényezők (patogenetikai faktorok), – a dohányzás, a II-es típusú cukorbetegség,[33] az elhízás,[34] más kutatók szerint az elhízás (magas testtömeg index) és a túlzott kalóriabevitellel együtt (külön ez a két tényező önmagában nem),[35] valamint különféle toxinok (mérgek: növényvédő szerek, azbeszt, benzol valamint a klórozott szénhidrogének)[33] szerepe[34] bizonyult meghatározónak.[36]
Habár a betegség familiáris (örökletes, családi halmozódásos) formája is ismert, ezen esetek száma elenyésző (a hasnyálmirigyrákok 5–10%-a),[37] és pontos genetikai hátterét ez idáig nem sikerült meghatározni.[36] Annyi bizonyos, hogy a hasnyálmirigyrák familiáris formája nagyobb eséllyel alakul ki a következő tünetcsoportokban (szindrómákban), illetve más, nem a hasnyálmirigy állományából kiinduló daganatos elváltozásokban szenvedőkben: herediter dysplasiás naevus-szindróma (FAMMM-szindróma), Peutz-Jeghers-szindróma, familiáris emlő- és örökletes hasnyálmirigy-gyulladás, örökletes nem polipózus kolorektális karcinóma (HNPCC), familiáris adenomatózus polipózis (FAP), valamint Li-Fraumeni-szindróma (LFS).[38] A hasnyálmirigyrákok 90–95%-a duktális adenokarcinóma, amelynek pre invazív[megj. 11] és invazív[megj. 12] formája ismert.[36] Az invazív, azaz lokális és távoli áttétet adó forma megelőző elváltozásait (a ductus hámjának hiperpláziás,[megj. 13] metapláziás[megj. 14] és diszpláziás[megj. 15] elváltozásai) pancreas intraepithelialis neoplasia (PanIN) néven tartják számon, és különböző súlyosságú fokozatokba sorolják őket.[39] Ezen elváltozások mind pre invazívak, és a duktális karcinóma előalakjának tekinthetőek.[36] A PanIN 1A-ban a normális köbhám helyén mucinban gazdag, viszonylag magas hengerhám figyelhető meg, amelyet nem jellemez atípia[megj. 16] és papilláris formációk jelenléte. A PanIN 1B stádiumra jellemző, hogy az előbb leírtakon kívül mikropapilláris átalakulás is megfigyelhető. A PanIN 2 valamivel súlyosabb, enyhe vagy mérsékelt atípia jellemzi, míg a legrosszabb továbbterjedési képesség előtti (preinvazív) forma, a PanIN 3 (ez már carcinoma in situ) – azaz „még helyben maradó rák” – esetében kifejezett sejtes típuseltérést (celluláris atípiát) figyelhetünk meg. Ezekben a preinvazív valamint továbbterjedő (invazív) formákban számos, különböző genetikai hibák fokozatos felhalmozódása figyelhető meg. Az esetek mintegy 80%-ban a K-RAS gén mutációja, valamint a HER2/neu (c-erbB-2) gén fokozott kifejeződése domináns.[36] Ezekhez társul az esetek 50–60%-ában bizonyos tumorszuppresszor gének,[megj. 17] mint például a p16, p53, SMAD4 inaktivációja,[36] illetve bizonyos növekedési faktorok[megj. 18] (epidermal growth factor [EGF], transforming growth factor alfa és béta 1-3 [TGF-alfa, TGF-béta 1-3], valamint az acidic fibroblast growth factor [aFGF]) fokozott aktivitása.[40] A duktális variánsokkal ellentétben az acináris formában a K-RAS és a p53 mutációja meglehetősen ritka, valamint a p16 és a SMAD4 gén hibája sem mutatható ki.[36] Az esetek 90%-ában deléciók mutathatóak ki a 18-as kromoszómában,[41] valamint a betegek többségében fokozott telomeráz aktivitást is azonosítottak.[42]
A hasnyálmirigyrák rizikófaktorai[szerkesztés]
A betegség kialakulását elősegítő tényezők a következők:[28][43]
Rákkeltő anyagok hatása[szerkesztés]
- Dohányzás[43]
A hasnyálmirigyrákos esetek 25%-a tulajdonítható a dohányzásnak.[41][44] Dohányzó egyénekben 2–3-szor nagyobb eséllyel alakul ki hasnyálmirigyrák, mint a nem dohányzókban.[41] Egy a dohányfüstben megtalálható nitrózaminnal, a Methylnitrosamino-pyridyl-butanoneal kutatók, állatkísérletekben, hasnyálmirigyrákot idéztek elő.[45] Dohányzó személyek boncolásakor szinte minden alkalommal felfedezhető bizonyos mértékű ductushiperplázia.[41] A rák kialakulásának esélye a naponta elszívott cigaretta mennyiségével arányosan nő.[25] A legnagyobb, 10-szeres kockázati értéket azon egyéneknél mérték, akik naponta 40 szál cigarettát szívtak el.[25] Szűrővel ellátott cigaretta fogyasztása nem csökkenti a kockázat mértékét.[44]
- Azbeszt, benzol, növényvédő szerek[41]
A kevés rendelkezésre álló adat elemzésének eredményei arra utalnak, hogy a növényvédő szereknek, az azbesztnek, a vegyiparban oldószerek, gyógyszerek, festékek, robbanóanyagok és növényvédő szerek előállítására nagy mennyiségben használt benzolnak valamint a növényvédő szerként használt[46] klórozott szénhidrogéneknek való kitettség emberek esetében növelheti a hasnyálmirigyrák kialakulásának kockázatát.[47]
- Kadmium, műanyag adalékanyagok
A kadmiumról (melyet többek között lakkokban és műanyagokban például PVC-ben, olvadóbiztosítékban használnak), bebizonyosodott, hogy már az alacsony és közepes kadmium kitettség is összefüggésbe hozható a tüdő és a hasnyálmirigyrák miatt bekövetkező halálozás kockázatának növekedésével.[48] A kadmium felhasználása széleskörű, használják a fentieken túlmenően aranyzöld ékszerötvözetekben, fékekben súrlódó anyagként, világító festékekben, fekete-fehér katódsugárcsőben, kék és zöld katódsugárcsőben, fényességmérőkben, infravörös kamerákban, műanyagokban stabilizátorként, kadmium-lámpában, elektrofiziológiában feszültségaktív kalciumcsatornák blokkolására, valamint színes üvegekben.
Cuomo és munkatársai a legfőképpen polikarbonát műanyagokban[megj. 19] megtalálható[49][50][51] Biszfenol A nevű kemikália, hasnyálmirigy rák kialakulásában betöltött lehetséges szerepére hívja fel a figyelmet.[52] Kutatási eredményeiket megerősíteni látszik Alonso-Magdalena és munkatársainak kutatási eredménye, melyben a Biszfenol A- nak való kitettség, 2-es típusú cukorbetegség kockázatnövelő hatásával hozzák összefüggésbe, a 2-es típusú cukorbetegség ugyanis a hasnyálmirigyrák kialakulásának egyik rizikófaktora.[53] Bár az összefüggést a Biszfenol A, vizeletben való emelkedett szintje és a cukorbetegség között többen is kiumutatták (Például Lang és munkatársai), a Biszfenol A pontos szerepe a cukorbetegség kialakulásában egyelőre vitatott.[54][55] Ugyanakkor a Biszfenol A-nak való kitettség és a rákbetegség, az elhízás, valamint a szív- és érrendszeri betegségek közötti kapcsolat korábban számos esetben felmerült. A Biszfenol A, Fenichel és munkatársai szerint a hasnyálmirigy normál működésébe úgy avatkozik bele, hogy stimulálja az inzulin szekréciót.[56] Lin és munkatársainak kutatása szerint az egyre halmozódó bizonyítékok arra utalnak, hogy a Biszfenol A-nak való kitettség összefüggésbe hozható a β-sejt diszfunkcióval.[54] Ennek azért van jelentősége, mert az inzulinrezisztencia és a β-sejtek szekréciós zavarának együttes jelenléte által alakul ki a 2-es típusú cukorbetegség.[57] Selenskas és munkatársai a műgyantafeldolgozó iparban (melyben többek között Biszfenol A-t is használnak) hosszabb ideje dolgozók között a hasnyálmirigyrák gyakoribb előfordulását figyelte meg.[58]
- Aromás és halogénezett szénhidrogének, nitrózaminok
A policiklusos szénhidrogénekről melyek például az üzemanyagok (mind a fosszilis, mind a biomassza eredetűek) égetése során melléktermékként keletkeznek, valamint a nitrózaminokról is bebizonyosodott, hogy állatok esetében hasnyálmirigyrákot indukálnak. A nitózaminok élelmiszerekben nitritekből és szekunder aminokból keletkezhetnek a füstölt húsok, sonkák, szalonnák, magas hőmérsékleten való sütésekor,[59] grillezésekor.[60] Szíriai arany hörcsögök esetében magas hasnyálmirigy daganat előfordulást váltottak ki nitrózaminnal: hetente egyszeri, bőr alá injekciózott diisopropanolnitrosamine (DIPN) alkalmazásával. A legrövidebb tumor látencia 15 hét volt. A DIPN-el indukált hasnyálmirigy-daganatok klinikai és morfológiai szempontból nagyon hasonlítottak az emberi daganatokra.[61] Emberben mindez idáig ezt az összefüggést nem bizonyították, illetve az bebizonyosodott, hogy az N-nitrozaminokkal való foglalkozásbeli érintkezés és a hasnyálmirigyrák kialakulása között nem találtak kapcsolatot. (gumigyárban, fémiparban, bőriparban dolgozók, növényvédő szereket használók esetén)[41][62] Ugyanakkor 1995-ben halogénezett szénhidrogéneknek való kitettségben dolgozó Finn munkások esetében figyelték meg, többek között a hasnyálmirigyrákos betegség gyakoribb előfordulását.[63] A halogénezett szénhidrogéneket főként műanyag és textil égésgátló adalék vagy bevonó anyagként, tűzoltó anyagként, hűtőközegként, aeroszol-hajtógázként, oldószerként, valamint a gyógyszeripari alapanyagként használják.
Életmód, és táplálkozási szokások[szerkesztés]
- Vörös és feldolgozott húsok fogyasztása. Bár a vörös hús valamint a feldolgozott húskészítmények rákkeltő hatása emberek esetében nem bizonyított, a kutatások azt bizonyítják, hogy a vörös húsok valamint, különösen a feldolgozott húskészítmények rendszeres fogyasztása növeli a hasnyálmirigyrák kialakulásának kockázatát.[43][64][65]
- Elhízás,[66][67][68] megnövekedett testtömeg index, és magasabb kalóriabevitel,[69] más kutatások szerint pedig a nagyobb mennyiségű hús- és egyéb állati eredetű termékek, a keményítőben gazdag ételek, valamint a (finomított) gabonafélék és a finomított cukor rendszeres fogyasztását találták kockázatnövelő tényezőnek.[70] A túlsúly csökkenti a sikeres terápia esélyét is.[71]
- Gyümölcs- és zöldségszegény táplálkozás.[43][72] Több tanulmány is igazolta, hogy a gyümölcsben és zöldségben gazdag táplálkozás csökkenti a hasnyálmirigyrák kialakulásának esélyét.[73][74][75][76][77] A védőhatást a gyümölcsökben és a zöldségekben megtalálható vegyületek (folsav,[74][78] antioxidánsok: karotinok,[74][75][78] valamint az E[74][75][78] és C[74][75][78]-vitaminok) fejtik ki. Az is bizonyítást nyert, hogy a hagyma, a fokhagyma, a babok, a sárgarépa, az úgynevezett „sárga zöldségek”, a „sötét levelű zöldségek”, valamint a káposztafélék bírnak a legnagyobb protektív hatással, de csak akkor, ha mértékkel fogyasztjuk őket. Hasnyálmirigy-gyulladás esetén a fokhagyma, hagyma, a bab és mindenféle fűszer fogyasztása kifejezetten tiltott.[72]
Egyéb betegségek és fertőzések[szerkesztés]
- Cukorbetegség[28][43][79][80] A hosszú ideig fennálló, kettes típusú cukorbetegséget hozták összefüggésbe a hasnyálmirigyrák megjelenésével.[33] Az elváltozás hatszor gyakoribb a diabéteszes, mint a nem diabéteszes nők körében. Férfi betegek esetében ez az arányszám nem állapítható meg.[4]
- Krónikus pancreatitis (krónikus hasnyálmirigy gyulladás).[28][43]
- Helicobacter pylori fertőzés.[43][81]
- Pancreasrák a családi anamnezisben (a rák kialakulásának valószínűsége a triplájára nő, amennyiben a családban már előfordult ez a betegség).[28][43]
- Gingivitis (a fogíny gyulladása) és periodontális (fog körüli) betegségek.[82]
- Májcirrózis.[43]
Genetikai kockázatok[szerkesztés]
| Genetikai szindrómák amelyek esetében a hasnyálmirigyrák gyakoribb | |||||||||||||
| Szindróma neve | Gén neve | Lokalizáció a kromoszómán | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Örökletes pancreatitis | PRSS1 | 7q35 | |||||||||||
| HNPCC[megj. 20] | MSH2 MLH1 PMS2 PMS1 |
2p 2p 7p 2q | |||||||||||
| Familiáris emlő és | BRCA2 | 13q | |||||||||||
| FAMMM[megj. 21] | P16 | 9p | |||||||||||
| FAP[megj. 22] | APC | 5q21-q22 | |||||||||||
| A-T[megj. 23] | ATM | 11q22 | |||||||||||
| Peutz-Jeghers | STK11 | 19p | |||||||||||
| Cisztás fibrózis | CFTR | 7q31-q32 | |||||||||||
|
Forrás[83] | |||||||||||||
- Genetikai mutációk: K-RAS onkogén aktivációja (az esetek 100%-ban); p16, p53, SMAD4, DPC4, BRCA2 tumorszupresszor-gének inaktivációja.
- Örökletes betegségek, szindrómák (örökletes pancreatitis; MEN1 (multiplex endokrin neoplázia 1); vastagbélrák; Von Hippel-Lindau szindróma; ataxia telangiektázia; Peutz-Jeghers szindróma).[43][84]
Egyéb tényezők[szerkesztés]
- Kor: 60 év felett gyakoribb.[28][43]
- Nem: férfiakban gyakoribb[28][43] Feltehetően azért, mert a férfiak többet dohányoznak.[85] Ezen elméletet az is alátámasztja, hogy nem dohányzó hasnyálmirigyrákban szenvedőknél nemi eltérés nem tapasztalható.[25]
- Faji hovatartozás. Afro-amerikaiakban gyakoribb.[28][43] Askenázi zsidókban gyakoribb.[5][85][86] Feltehetően a BRCA2 gén mutációja áll a háttérben, amely sokkal gyakoribb az askenázi zsidó populáció körében.[85]

Vitatott hatású tényezők
- Kávéfogyasztás[87][88][89] Vitatott.[4] Egyes régebbi kutatások eredménye szerint összefüggés mutatható ki a kávéfogyasztás és a hasnyálmirigyrák kialakulása között, de az újabb vizsgálatok ezt a feltevést nem erősítették meg.[43]
- Cukrozott szénsavas üdítőitalok fogyasztása.[90] Korábban feltételezték, hogy cukrozott, magas glikémiás töltéssel (GL, glycemic load) bíró szénsavas üdítőitalok, gyümölcs- és zöldséglevek fogyasztása fokozhatja a hasnyálmirigyrák kialakulásának esélyét.[90] Egy 14 évig tartó 60 524 önkéntest érintő vizsgálat arra az eredményre jutott, hogy azon személyek körében, akik napi több mint két pohár cukrozott szénsavas üdítőitalt fogyasztottak, gyakrabban fordult elő hasnyálmirigyrák.[90] A cukrozott gyümölcs, valamint zöldséglevek fogyasztása és a hasnyálmirigyrákos megbetegedések kialakulása között nem sikerült összefüggést kimutatni.[90]
- A zsírban dús étrend fogyasztásáról korábban úgy gondolták, hogy hatással van a kockázat növekedésére,[28][43] de bizonyos tanulmányok készítői (például Nöthlings és munkatársai) arra az eredményre jutottak, hogy a zsírfogyasztásnak nincs hatása a kockázatnövekedésre. Kockázatnövekedést még a telített zsírok esetében sem tudtak kimutatni.[91]
- Alkoholfogyasztás. Az jelenleg vita tárgyát képezi, hogy az alkoholfogyasztás mennyire játszik döntő szerepet a daganat kialakulásában. A masszív alkoholfogyasztás, alkoholizmus a krónikus pancreatitis egyik legfőbb oka, ami viszont a hasnyálmirigyrák bizonyított rizikófaktora. A legújabb vizsgálatok szerint azonban az alkohol kiváltotta pancreatitis nem okoz nagyobb valószínűséggel hasnyálmirigyrákot, mint a más tényezők által keltett hasnyálmirigy-gyulladás.[92][93][94] Egyes vizsgálatok azonban összefüggést feltételeznek a daganat előfordulása és a megnövekedett alkoholbevitel között.[13][95][96] A legveszélyeztetettebbek az erős italozók.[97][98][99][100] Egy dán kutatás arra az eredményre jutott, hogy a fehérbort fogyasztók között a rák kialakulásának valószínűsége alacsonyabb.[101] A kutatók többsége egyetért abban, hogy ha valaki napi 30 gramm, vagy annál több alkoholt (két pohár italt) fogyaszt, kis mértékben növeli a hasnyálmirigyrák kialakulásának kockázatát. Egy ital a kutatók meghatározása szerint 3,5 dl sört, 1,2 dl bort vagy 0,4 dl 40 fokos égetett szeszt jelent. Más kutatók, például Silverman megkérdőjelezik a hasnyálmirigyrák és az alkoholizmus közötti kapcsolatot, bár a rendszeresen nagyobb mennyiségű alkoholt fogyasztók esetében elképzelhetőnek tartja a kockázatnövekedést.[35]
A génmutációk kialakulásának feltételezett mechanizmusai[szerkesztés]
|
Szövettani metszetek
|
A szervezetbe jutott rákkeltő anyagokat (dohányfüst komponensei, ipari karcinogének, táplálkozással bevitt anyagok stb.) a máj igyekszik eltávolítani a szervezetből nem mérgező vízoldékony vegyületekké alakítva, amelyeket végül az epével választ ki. A reflux elmélet szerint inaktivált karcinogén anyagokat tartalmazó epe éri a hasnyálmirigy sejtjeit – a Wirsung vezeték révén –, amelyeket a hasnyálmirigy enzimjei aktiválnak, majd az ismét karcinogén ágensek következtében a hasnyálmirigy sejtjei génmutációt szenvednek, és rákos sejtekké alakulnak. Karcinogén aktivátor enzimrendszerek jelenléte a hasnyálmirigy sejtjeiben már bizonyított. A legelső vizsgálatok során in vitro körülmények között tanulmányozták a hasnyálmirigy vezetékében végbemenő változásokat benzopirén és 7,12-dimetilbenzantracén (DMBA) hatására. A kísérlet során reaktív intermedier vegyületek[megj. 24] keletkeztek, amelyeket sikerült azonosítani a DNS-hez kötődve. Későbbi tanulmányok, mint például Foster és munkatársai által végzettek, több enzim szerepét is felvetették. Foster a P450-3A1, P450-2E, P450-1A2, a citokróm P450 oxidoreduktáz, valamint a glutátion S-transzferáz (GST) 5-5 jelenlétét igazolta. Míg PCR eljárással a CPY 1A1 és 2E1 géntermékek fokozott kifejeződését sikerült izolálni, addig Northern blottal ennek éppen az ellenkezőjét sikerült alátámasztani sebészileg eltávolított mintából. Egy másik, 29 főt érintő vizsgálat nem talált összefüggést a hasnyálmirigyrák kialakulása, valamint a különböző, a mirigy sejtjei által termelt enzimek (P450 1A2, 3A4, 1A1, 2B6, 2E1) aktivitása között. A különböző kísérletek eredményei közötti ellentmondásokat feltehetően az alkalmazott technikák közötti eltérések okozták. Azt azonban biztosan ki lehet jelenteni, hogy a hasnyálmirigy sejtjei által termelt citokróm P450 enzimek nem játszanak jelentős szerepet a karcinogének aktiválásában. Tizenkét normál és 26 adenokarcinómás szövetet érintő vizsgálatban a rákos szövetek 54%-a GST-π-t, 8%-uk pedig GST-α-t ürített, míg a rákos és a normális szövet sem termelt GST-μ-t. Egy másik, 81 rákos beteget, 79 fős kontroll csoportot, valamint 119 fős, krónikus hasnyálmirigy-gyulladásban szenvedő pácienst érintő vizsgálat a NAT1 acetilező enzim megemelkedett szintjét mutatta ki.[102]
Egy másik jelentős elmélet szerint a hasnyálmirigy sejtjeinek génállományában kialakuló génmutációkat, és így rákos sejtekké való alakulásukat a szervezetbe jutott karcinogének – illetve azok intermedierjei – úgy okozzák, hogy kötődnek a hasnyálmirigy sejtjeinek DNS-éhez, tehát az előbbi elmélettel ellentétben a hasnyálmirigynek aktív szerepe (karcinogének aktiválása) nem domináns. Patkányokon és kutyákon végzett kísérletek szerint a per os[megj. 25] adott 2-amino-1-metil-6-fenilimidazol-piridin több sejt DNS-éhez kapcsolódott, de leginkább a hasnyálmirigy sejtjeihez. Kísérletek igazolták, hogy hasonló folyamatok zajlanak le az emberekben is, annak ellenére, hogy az első vizsgálatok épp az ellenkezőjét látszottak alátámasztani. Egy jelentősebb vizsgálat 29 mintát vett szemügyre. A 13 dohányzó személy mintájából ötben, míg a 16 nem dohányzó mintájából mindössze háromban észleltek DNS-hez kötődő karcinogéneket, amelyek közül a 4-amino-bifenil (4-ABF) domináns volt. A 4-aminobifenil egy aromás amin, amelynek mennyisége a dohányfüstben jelentős. A kísérlet eredménye arra is enged következtetni, hogy a hasnyálmirigy sejtjei a karcinogén aromás aminok célpontjai.[102]
Az örökítőanyag károsodását különböző endogén folyamatok is kiválthatják, mint például az oxidatív stressz. Régóta ismert tény, hogy a szabad gyökök jelentős szerepet töltenek be a gyulladásos folyamatokat kísért szövetkárosodásban, illetve bizonyos rákos folyamatokban. Reaktív szabad gyökök nem pusztán a dohányfüst révén kerülnek be a szervezetbe, hanem fiziológiásan is képződnek bizonyos metabolikus folyamatok során. A szabályozatlan módon képződő szabad gyökök rendkívül reaktívak, a legveszélyeztetettebbek a többszörösen telítetlen szabad zsírsavak, illetve az ezeket tartalmazó sejtkomponensek. Ilyen oxidálódott lipideket sikerült azonosítani akut hasnyálmirigy-gyulladásos esetekben, jóval a látható morfológiai jegyek megjelenése előtt. Több tudományos vizsgálat is igazolta a különböző lipid peroxidációs termékek DNS-hez való kötődését hasnyálmirigyrákból származó szövetmintákból.[102]
Szignalizációs útvonal defektusok[szerkesztés]
Berman (2003) bizonyította először, hogy az emésztőtraktusból kiinduló daganatok többsége (nyelőcső, gyomor, hasnyálmirigy, epe utak) fokozott hedgehog jelút (hedgehog, sündisznó és a II. világháborúban tengeralattjárók ellen használt egyik mélységi elhárítóbomba neve)[megj. 26] aktivitást mutat, amely elnyomható egy cyclopamin nevű antagonistával.[megj. 27] Mindemellett a cyclopamin in vitro körülmények között (szervezeten kívül) gátolta a sejtek növekedését, és a daganatos sejtek tartós visszafejlődését indukálta. E gasztroenterikus[megj. 28] tumorok esetében a daganatos burjánzást az endogén termelődött, nagymértékben felszabadult hedgehog ligandok okozták. Berman arra a következtetésre jutott, hogy néhány malignus halálos rákos átalakulás nem genetikai mutációkra vezethető vissza, hanem ligandok (jelmolekulák) által előidézett fokozott sejtaktivációra.[103]
Thayer (2003) vette észre, hogy a sonic hedgehog jelösvény abnormálisan kifejezett hasnyálmirigyrákban és annak megelőző elváltozásában, a pankreász intraepitheliális neoplázájában (PIN). Az ilyen elváltozást hordozó egerekben abnormális hasnyálmirigy ductus struktúrák alakultak ki. E PIN-szerű elváltozások KRAS és ERbb2 mutációkat is hordoztak. Az előbb említett mutációkat a korai stádiumú hasnyálmirigyrákokban szinte mindig azonosítják. Thayer azt is megfigyelte, hogy a hedgehog jelösvény a daganatos sejtekben továbbra is aktív marad. A cyclopaminos kezelés gátolta a sejtburjánzást in vivo és in vitro egyaránt, továbbá indukálta a rákos sejtek apoptózisát.[104]
A leggyakoribb génmutációk hasnyálmirigyrákban[szerkesztés]
| Hasnyálmirigyrákban mutálódott gének illetve azok lokalizációja a kromoszómán | |||||||||||||
| Gén neve | Lokalizáció a kromoszómán | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ARHC (RhoC) | 1 p21-p13 | ||||||||||||
| SLC2A1 (GLUT1) | 1 p35-p31.3 | ||||||||||||
| ID2 | 2 p25 | ||||||||||||
| TGFBR2 | 3 p22 | ||||||||||||
| FGFR1 | 8 p11.2-p11.1 | ||||||||||||
| CDKN2A (P16, INK4A, MTS1) | 9 p21 | ||||||||||||
| TGFBR1 (ALK5, ACVRLK4) | 9 q33-q34 | ||||||||||||
| KAI1 (CD82, R2, ST6) | 11 p11.2 | ||||||||||||
| MEN1 (MENIN) | 11 q13 | ||||||||||||
| KRAS2 (Ki-ras, KRAS, K-RAS) | 12 p12.1 | ||||||||||||
| CD9 (p24, MIC3, BA2) | 12 p13 | ||||||||||||
| BRCA2 | 13 q12.3 | ||||||||||||
| MAP2K4 (MKK4, SEK1, JNKK1) | 17 p11.2 | ||||||||||||
| MADH4 (DPC4, SMAD4) | 18 q21.1 | ||||||||||||
| DCC (CRC18, CRCR1) | 18 q21.3 | ||||||||||||
| STK11 (LKB1, PJS) | 19 p13.3 | ||||||||||||
| AKT2 | 19 q13.1-q13.2 | ||||||||||||
| BAX | 19 q13.3-q13.4 | ||||||||||||
| TFF1 (D21S21, BCEI) | 21 q22.3 | ||||||||||||
|
Forrás:www.cancer-genetics.org[105] | |||||||||||||
K-ras[szerkesztés]
A 12. kromoszóma p13 lokuszán elhelyezkedő K-ras proto-onkogén a leggyakrabban mutálódott gén hasnyálmirigyrákos megbetegedésekben. A K-ras – a H-ras és N-ras génekkel együtt – a Ras géncsalád tagja, és egy 21 kDa tömegű, sejtmembránhoz kötött guanin nukleotid kötő, guanozin trifoszfatáz (GTPáz aktivitással bíró) fehérjét kódol. E gén mutációját más rákos betegségekben is azonosították, azzal a kivétellel, hogy hasnyálmirigyrákban szinte kizárólag a 12-es kodon érintett (az esetek 71–100%-ában). A génben lezajló mutációk módosítják a protein GTP hidrolizáló képességét, amelynek köszönhetően az enzim állandóan GTP-t köt. Mivel a Ras fehérjék fő feladata az extracelluláris („sejten kívüli”) térből érkező növekedést serkentő jelzések továbbítása különböző sejtdifferenciálódást és osztódást lebonyolító intracelluláris („sejten belüli”) jelösvények felé, könnyen belátható, hogy e fehérjék állandó aktivitása szabályozatlan sejtosztódáshoz vezet. A K-ras gén mutációit sikerült azonosítani a PanIN esetek 28–81%-ában is, ami arra enged következtetni, hogy e gén mutációja esszenciális szereppel bír a karcinogenezis[megj. 29] beindításában.[106]
HER2/neu (c-erbB-2)[szerkesztés]
A HER2/neu gén egy 185 kDa tömegű, az epidermális növekedési faktor (EGF) receptorához nagyon hasonló, tirozin-kináz aktivitással bíró transzmembrán glikoprotein receptort kódol. A K-ras-hoz hasonlóan a Her2/neu is olyan szignálok továbbításában játszik szerepet, amelyek az exokrin pancreas sejtjeinek az osztódását, illetve differenciálódát szabályozzák. Szerepe más rákos megbetegedésekben (pl. emlőrákban) is bizonyítást nyert. Túlzott mértékű kifejeződését a hasnyálmirigyrákos esetek 17–58%-ában azonosították. Feltételezik, hogy a mutáns K-ras génhez hasonlóan jelentős szereppel bír a karcinogenezis beindításában. Ezt a feltételezést az a tény is alátámasztja, hogy e gén mutációja gyakrabban fordul elő a hasnyálmirigyrák megelőző lézióiban, mint az előrehaladott és rosszul differenciált formákban. Habár az ez irányú vizsgálatok eredményei ellentmondásosak, a HER2/neu kifejeződése befolyásolhatja a hasnyálmirigyrák várható prognózisát.[106]
TP53 (p53)[szerkesztés]
A TP53, vagy p53 egy tumorszupresszor gén, amelynek a mutáns változata kimutatható valamennyi rákfajtában. A p53, vagy 2.7.1.37-es EC számú fehérjét kódolja, mely a sejtciklus szabályozója és tumorszupresszor is egyben. A p53 számos tumor ellenes mechanizmussal bír:
- DNS károsodást helyreállító fehérjéket aktiválhat,
- képes blokkolni a sejtciklust a G1/S átmenetben, valamint
- apoptózist, azaz sejthalált is kiválthat.
A hasnyálmirigyrákos esetek 40–80%-ából izolálható. Inaktivációját az esetek többségében pontmutáció (70%), illetve deléció okozza. Mivel a szérum p53 szintje és a hasnyálmirigyrák progressziója között párhuzam figyelhető meg, intenzív kutatások folynak az enzim lehetséges tumor markerként való felhasználásáról. A legújabb vizsgálatok kimutatták, hogy e gén érintettsége csökkenti a páciens túlélési esélyeit.[106]
CDKN2 (p16)[szerkesztés]
A p16 a p15-tel valamint a p19ARF-fel alkotja a ciklin dependens inhibitorok (CDI) INK4 családját. Fő funkciójuk a sejtciklus szabályozása, pontosabban annak gátlása. Mivel e gének egymáshoz közel helyezkednek el a kromoszómán, egyikük deléciója általában a másik törlődésével is jár, ami a sejtciklus féken tartásának jelentős károsodását eredményezi. A p16 enzim a CDKN2 gén terméke, a ciklin dependens kináz 4-hez (CDK4) kötődve gátolja az aktív D1/CDK4 komplex kialakulását. A D1/CDK1 komplex elsődleges feladata a retinoblasztóma (Rb) elnevezésű enzim aktiválása annak foszforilációja révén, aminek eredményeképp olyan folyamatok láncolata indul meg, amelyek lehetővé teszik a sejtosztódás folytatását. A p16 gén károsodása révén olyan kóros szerkezetű p16 fehérje keletkezik, amely képtelen biológiai funkcióját betölteni, így a korlátlan sejtosztódás gátlása elvész. A p53 gén károsodásához hasonlóan, azon páciensek, akikben a p16 érintettségét igazolták (a hasnyálmirigyrákban szenvedők 80–98%-a) csökkent túlélési eséllyel rendelkeznek.[106]
DPC4 (Smad4)[szerkesztés]

Az ADPC4 egy tumorszupresszor gén, ami a Smad4 elnevezésű transzripciós faktort kódolja. A Smad4-et a legújabb vizsgálatok szerint a TGF-β jelösvény aktiválja, ami végső lépésben a sejtciklus megállítására képes (G1 és S fázis határa) enzimek, a p21 és p15 transzkripcióját eredményezi. Mindemellett a TGF-β útvonal képes gátolni a hámsejtek osztódását, valamint egyes sejttípusok differenciálódását is elindítja. A sejtfelszíni TGF-β receptor aktiválódását követően intracelluláris folyamatok sorozata indul meg. A citoplazmában foszforilálódnak a Smad1 és a Smad2 proteinek, amelyek a Smad4 proteinhez kapcsolódva komplexet képeznek. A komplex a sejtmaghártyán át transzlokálódik a sejtmagba, ahol transzkripciós faktorként viselkedve elindítja a már korábban említett p15, valamint p21 gének kifejeződését. A DPC4 gén inaktiválódása esetén elvész a TGF-β jelösvény indukálta proliferációs gátlás.[106]
Fokozott aktivitással bíró növekedési faktorok[szerkesztés]
EGF[szerkesztés]

Az epidermális növekedési faktor (Epidermal Growth Factor, EGF) receptor egy 170 kDa tömegű, tirozin-kináz aktivitással bíró transzmembrán glikoprotein, amelyet különböző aktivátorok (úgynevezett ligandok) (EGF, TGF-alfa, heparin-binding (HB)-EGF) hoznak működésbe. Aktiválódásuk során előbb intracelluláris részeik dimerizálódnak, amelyet aztán tirozin komponenseik foszforilációja követ. Az utóbbi lépés lehetővé teszi különböző intracelluláris, sejtnövekedést és sejtdifferenciációt befolyásoló jelösvények (mitogen-activated protein (MAP) kináz, PI3-kináz, és foszfolipáz C-gamma) aktiválódását. Ennek következtében a receptor vagy aktivátorainak fokozott kifejeződése a sejtosztódás feletti kontroll elvesztését eredményezheti. Az EGF és TGF-alfa ligandok jelenlétét már korábban is sikeresen igazolták normális hasnyálmirigyszövetben. Hasnyálmirigyrák sejtkultúrákhoz adott EGF, TGF-alfa valamint HB-EGF receptor aktivátorok sejtosztódást indukáltak -különösen a TGF-alfa- a rákos sejtekben. Több jelentős kutatásnak hála az EGF receptor és aktivátorainak hasnyálmirigyrákban való fokozott kifejeződése beigazolódott. A receptor túlzott mértékű kifejeződése az esetek 30–50%-ban, míg aktivátorainak fokozott jelenléte az esetek 12–46, (EGF) illetve 50–85%-ban (TGF-alfa) nyert bizonyítást.[106]
FGF[szerkesztés]
A fibroblaszt növekedési faktor (Fibroblast Growth Factor FGF) család kilenc tagja, többek között az (a)FGF/FGF1, a (b)FGF/FGF2 valamint a KGF/FGF-7 több sejttípusban is sejtosztódást, sejtdifferenciálódást, továbbá angiogenezist indukálnak. Az FGF aktivátorok két, alacsony valamint magas affinitású receptorokhoz képesek kötődni. A magas affinitású FGFR-1, FGFR-2, FGFR-3, illetve az FGFR-4 receptorok az EGF receptorhoz hasonlóan tirozin-kináz aktivitású transzmembrán glikoproteinek. Az alacsony affinitású receptorok önállóan nem képesek szignalizációs intracelluláris útvonalakat aktiválni, viszont képesek az FGF ligandoknak a magas affinitású receptorokhoz való kapcsolatát módosítani. Az FGF aktivátorok nyolcszor, illetve tizenegyszer nagyobb mennyiségben fordultak elő hasnyálmirigyrákból származó szövetmintákban, mint a normális hasnyálmirigyszövetből származó mintákban. Kutatások igazolták, hogy a (b)FGF ligandok fokozott jelenléte – ellentétben az (a)FGF-fel – csökkentik a hasnyálmirigyrákban szenvedő beteg túlélési esélyeit.[106]
TGF-béta[szerkesztés]

A transforming growth factor beta (TGF-béta) növekedési faktor család tagjai képesek indukálni több sejt szöveti differenciációját, gátolják a hámsejtek növekedését, angiogenezist indukálnak, meghatározzák az extracelluláris mátrix összetételét, valamint immunszuppresszív hatással is bírnak. Szabályozatlan kifejeződésük több módon is befolyásolja a rákos folyamatokat. A TGF-béta aktivátorok három olyan receptorhoz (TBRI, TBRII, TBRIII) kötődnek amelyek megtalálhatóak a normális hasnyálmirigysejteken is. A TBRII egy szerin-treonin kináz aktivitással rendelkező transzmembrán protein. Működéséhez, azaz intracelluláris szignalizációs útvonalak beindításához szükséges a TBRI receptor is. A TBRI és II dimerizációja a Smad2-ből, Smad3-ból, valamint a Smad4-ből álló komplex képződését eredményezi. A komplex a sejtmagba transzlokálódik, ahol különböző gének transzkripcióját indukálja. A TBRIII nem rendelkezik direkt szignalizációs útvonal aktiváló képességgel, viszont képes a TBRII és a TBRI receptorok aktivitásának a befolyásolására. A legújabb vizsgálatok igazolták a TGF-béta családba tartozó aktivátorok, valamint receptoraiknak fokozott jelenlétét és aktivitását hasnyálmirigyrákban. A TGF-béta jelösvény érintettsége meghatározza a tumor agresszivitását, valamint negatív irányban befolyásolja a páciens túlélési esélyeit is.[106]
IGF[szerkesztés]

Az inzulinszerű növekedési faktor-1 (Insulin-like growth factor I, IGF-I), valamint az inzulinszerű növekedési faktor-2 (Insulin-like growth factor II, IGF-II) homológ polipeptidek, amelyek sejtosztódást indukálnak különböző sejttípusokban. A hasnyálmirigy Langerhans béta sejtjei által termelt inzulinnal ellentétben e inzulinszerű proteineket több sejt is termeli de karcinogenezisben betöltött szerepük – az inzulinnal együtt – még nem teljesen tisztázott. Az inzulin receptorához hasonlóan az IGF-I receptorok is tirozin kináz aktivitással rendelkező transzmembrán glikoproteinek. A receptor aktiválódását követően olyan intracelluláris kaszkádfolyamat indul meg, amely végső soron megváltoztatja a sejt metabolikus, valamint mitogén aktivitását. Az IGF-I receptor inzulint, IGF-I-et, valamint IGF-II-t is köt ellentétben az IGF-II receptorral, amely kizárólag IGF-I-re és IGF-II-re reagál. Az IGF-I, IGF-I receptor, valamint az IGF-II fokozott kifejeződése hasnyálmirigyrákban igazolt. Habár az IGF-II és az inzulin megemelkedett szintjét nem sikerült igazolni, az IGF-I receptorra gyakorolt hatásuk miatt feltételezik, hogy közrejátszhatnak hasnyálmirigyrák kialakulásában. Hasnyálmirigyrákból származó szövetkultúrákon végzett kísérletek, amelyek során IGF-I receptor ellenes ellenanyagot juttattak a sejtkultúrára a rákos sejtek osztódásának a gátlását eredményezte.[106]
VEGF[szerkesztés]

A vaszkuláris endoteliális növekedési faktor-A (vascular endothelial growth factor-A, VEGF-A) protein több fontos biológiai funkcióval is rendelkezik. Osztódásra serkenti az ér endotél sejtjeit, befolyásolja az erek permeabilitását, valamint angiogenezist (érújdonképződést) indukál. A VEGF-A receptorai (VEGF receptor-1 és VEGF receptor-2) tirozin-kináz-aktivitással rendelkeznek.[106][107] A normális hasnyálmirigyszövetből származó mintákkal ellentétben, pankreász karcinómából származó mintákban a protein megemelkedett (ötszörös) szintjét sikerült azonosítani. Vizsgálatok igazolták, hogy a fokozott VEGF-A szint növeli a tumor méretét, fokozza a vörösvértestszámot, valamint elősegíti a rák lokális terjedését.[106]
Megjelenési formái[szerkesztés]
Az exokrin állományból kiinduló malignus daganatok[szerkesztés]
| Hasnyálmirigyrák variánsok és azok százalékos megoszlása | |||||||||||||
| Szövettani kép alapján | Százalékos megoszlásuk | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Duktális adenokarcinóma | 92 | ||||||||||||
| Intraduktalis papilláris-mucinózus karcinómák | 2 | ||||||||||||
| Mucinózus cisztadenokarcinóma | 1 | ||||||||||||
| Acinussejtes karcinóma | 1 | ||||||||||||
| Egyéb daganatok | 3 | ||||||||||||
Az intraduktális papilláris-mucinózus karcinóma (IPM-karcinóma, malignus, azaz rák), az intraduktális papilláris-mucinózus adenómát (IPM adenóma, minimális atípia jellemzi, nem rák, benignus daganat), valamint a határeset intraduktális papilláris-mucinózus tumort (borderline, bizonytalan dignitású), összefoglaló néven intraduktális papilláris mucinózus neoplázia (IPMN) –nak is nevezik.[108] Az IPM-karcinóma tehát súlyos szöveti valamint celluláris atípiával rendelkező preinvazív IPMN variáns. Az invazívvá váló IPM-karcinóma nem különbözik a duktális adenokarcinómáktól.[39] Szövettanilag a leggyakoribb hasnyálmirigyrák az adenokarcinóma, amely az esetek döntő többségében duktális adenokarcinóma, amely – nevéből értetődően – a hasnyálmirigy külső elválasztású mirigyeinek csatornáiból, azaz a ductusokból indul ki.[109] Az adenokarcinóma grádusát a daganatos mirigysejtek szerkezeti differenciáltsága (mennyire emlékeztet az eredeti mirigy szerkezetére) szabja meg. Ennek értelmében az adenokarcinóma lehet magasan, mérsékelten, vagy alacsonyan differenciált. A mirigylumen tágassága, valamint a nyákszekréció megléte-hiánya, illetve annak mértéke is diagnosztikus értékkel bír. Amennyiben a szekretált nyák a lumenben halmozódik fel mucinózus nem cisztikus duktális adenokarcinómáról beszélünk, míg ha az a daganatos mirigysejtekben halmozódik fel – deformálva a sejtet – pecsétgyűrűsejtes rákról (carcinoma sigillocellulare) beszélhetünk. A hasnyálmirigyrákok 10%-át kitevő carcinoma adenosquamosum szintén duktális eredetű,[109] míg az óriássejtes pancreasrák bizonyítottan hisztiocita eredetű.[110] Az igen agresszív és ritka (az esetek mindössze 1%-a), korai áttétetképző, és ennek köszönhetően igen rossz prognózisú acináris sejtes karcinóma viszont neuroendokrin differenciációt mutat.[110]
A hasnyálmirigy neuroendokrin daganatai[szerkesztés]
A hasnyálmirigy Langerhans-sejtjeiből kiinduló daganatok (szigetsejtes neopláziák) képezik a hasnyálmirigy endokrin eredetű daganatait. Nagymértékű, szabályozatlan hormontermelő képességüknek köszönhetően (inzulin, glükagon, gasztrin, vazoaktív intesztinális peptid) különböző jellegzetes tünetekkel járó szindrómákat okozhatnak. Ezeket a tumorokat ezért inzulinómának, VIPómának, glükagonómának, szomatosztatinómának, valamint gasztrinómának nevezik. Fontos megemlíteni, hogy létezik hormont nem termelő, úgynevezett nem funkcionális variánsuk is. Az endokrin hasnyálmirigy-daganatok minden életkorban előfordulnak, de mindössze 10%-át alkotják a hasnyálmirigyből kiinduló tumoroknak. Gyermekkorban extrém ritkák, felnőtt nők és férfiak körében ritkán, de előfordulnak. Az előfordulás gyakoriságát tekintve nincs eltérés a nemek között. E daganatok gyakran invazívak, és áttétet is adnak. A benignus és malignus daganat elkülönítése a szövettani metszet képe alapján gyakran nehéz. A malignitás bizonyítéka az érinvázió, illetve az áttétek bizonyítása.[111]
| Daganat neve | Termelt hormon | Malignitás mértéke | Elhelyezkedés | Klinikai tünetek |
| Inzulinóma | Inzulin | (5–15%) | hasnyálmirigy | vércukorcsökkenés |
| Gasztrinóma | Gasztrin | (40–60%) | hasnyálmirigy (30–60%), patkóbél (30–40%), egyéb (10–20%) | multiplex fekélyek |
| VIPóma | VIP (Vasoactive Intestinal Peptid | (80%) | hasnyálmirigy | vízszerű hasmenés, alacsony vér kálium szint |
| Glükagonóma | Glükagon | (50–80%) | hasnyálmirigy | vérszegénység, glükózintolerancia, a bőr vándorló pirossága (Erythema migrans) |
| PPóma/nem aktív hasnyálmirigytumor | PP | > 60% | hasnyálmirigy | térfoglalás |
Inzulinóma[szerkesztés]

A Langerhans-szigetek béta sejtjeiből eredő inzulinóma a szigetsejtes neopláziák leggyakoribb formája (az esetek 75%-a). 90%-uk benignus daganat, de 5–10%-uk malignus, rákos viselkedést mutat. Autonóm, szabályozatlan inzulintermelésük miatt hypoglikémiás állapotokat idézhetnek elő. Az elváltozás általában kisebb, mint 3 cm, és műtéttel könnyen eltávolíthatóak (kivéve a malignus variánsok). A benignus változat szövettani képén a normális béta sejtekre emlékeztető sejtek figyelhetőek meg, azzal a kivétellel, hogy a sejtek gerendás (trabekuláris) struktúrát vesznek fel. A tumor nagy mérete (nagyobb, mint 3 cm), jelentős mitotikus aktivitás, valamint a nukleáris atípia jelenléte a daganat malignus jellegére utal.[111]
Gasztrinóma[szerkesztés]
A Langerhans-szigetek G sejtjeiből eredő gasztrinóma a második leggyakoribb szigetsejtes neoplázia, az esetek 70–90%-ban áttétet adó (leggyakrabban a környező nyirokcsomókba, valamint a májba) invazív rák, amely a gyomor savszekrécióját fokozó anyagot, gasztrint termel. Elektronmikroszkópos felvételen a daganat a patkóbél nyálkahártyájának gasztrin termelő sejtjeire emlékeztetnek. Az elváltozás Zollinger-Ellison szindrómát okoz, amelyet 1) gasztrin-hiperszekréció, 2) multiplex duodenális fekélyek jelenléte, valamint 3) a vér megemelkedett gasztrinszintje jellemez. Leggyakrabban a 30–50 év közötti férfiakban fordul elő.[111]
Glükagonóma[szerkesztés]
A Langerhans-szigetek alfa sejtjeiből eredő glükagonóma az esetek többségében (esetek kétharmada) a környező struktúrákat beszűrő, invazív rák. Meglehetősen ritka, a funkcionáló szigetsejtes daganatok mindössze 1%-a. Leggyakrabban 40–70 éves kor között fordul elő, enyhe női dominanciát mutatva. A fokozott glükagontermelés következtében a plazma glükagonszintje a normális 30-szorosa.[111]
Szomatosztatinóma[szerkesztés]
A Langerhans-szigetek D típusú delta sejtjeiből kiinduló szomatosztatinóma ritka, magányos, az esetek többségében malignus daganat, amely rendszerint már a diagnózis felállításakor áttétet ad. A betegség szomatosztatin szindrómát eredményez, amit közepes mértékű diabétesz, epekövesség, zsírszéklet, valamint hipoklórhidria jellemez. A klinikai képhez társulhat a vérben lévő inzulin-, valamint glükagonszint csökkenése. Néhány esetben fokozott kalcitonin-, illetve ACTH hormonszint is észlelhető.[111]
VIPóma (D1 tumor)[szerkesztés]
A Verner-Morrison szindrómát (emelkedett szintű VIP, profúz vizes széklet, hypokalémia, hipoklórhidria) eredményező VIPóma a Langerhans-szigetek D1-típusú delta sejtjeiből kiinduló, ritka, általában magányos, meglehetősen nagyra növő malignus tumor.[111]
PPóma[szerkesztés]
A PP-t (pankreász polipeptid) termelő tumorok ritka, általában benignus elváltozások, amelyek nem okoznak semmiféle szindrómát, csak emelkedett plazma PP szintet.[111]
Enterokromaffin-termelő daganatok[szerkesztés]
A hasnyálmirigy karcinoid daganatjai ritka malignus elváltozások, amelyek enterokromaffin sejtekből állnak. Amennyiben áttéted adnak a májba, karcinoid szindrómát okozhatnak.[111]
Az endokrin rák prognózisát meghatározó tényezők a WHO szerint
| Áttét | Regionális áttéta | Szövettani differenciáltság | Tumor mérete | Vaszkuláris invázió | Ki-67-Index | |
| Benignus | - | - | Magas | <2 cm | - | <2% |
| Benignus vagy alacsony malignitású | - | - | Magas | >2 cm | -/+ | <2% |
| Alacsony malignitású | + | + | Magas | >3 cm | + | >2% |
| Erősen malignus | + | + | alacsony | bármekkora | + | >30% |
Áttétképzés[szerkesztés]
|
Áttétek      |
Áttétképződés szempontjából az extracelluláris mátrix (ECM) degradálása kulcsfontosságú tényező, hiszen e folyamat nélkül sem lokális, sem távoli invázió nincs.[112] A mátrix metalloproteinázok (MMP-k) cinkion függő, membránhoz kötött enzimek, amelyek az extracelluláris mátrix komponensei iránt mutatnak affinitást, és képesek azok degradálására.[112][113] Az MMP enzimcsalád szubsztrátok szempontjából több csoportra is osztható.[112] Ennek értelmében megkülönböztethetünk kollagenázokat, illetve zselatinázokat. Karcinogenezisben betöltött szerepükön kívül ezen enzimek jelentős élettani szereppel is rendelkeznek: gyógyulásos folyamatokban, valamint az embriogenezisben is jelentős funkcióval bírnak. A mátrix metalloproteináz enzimek funkcióit különböző szöveti inhibítorok (tissue inhibitors of metalloproteinases, TIMPs) regulálják. A legjelentősebbek ezek közül a TIMP-1, TIMP-2, és a TIMP-3 fehérjék, amelyek irreverzibilisen kötődnek az MMP enzimekhez, megakadályozva ezzel őket funkcióik betöltésében. Rákos folyamatokban az MMP–TIMP arány az előbbi javára tolódik el, ami lehetővé teszi az ECM leépítését és a rák terjedését.[112] Habár jelenleg nem teljesen tisztázott, hogy mely MMP-k és TIMP fehérjék játszanak döntő szerepet a hasnyálmirigyrák terjedésében, az MMP-2, MMP-3, valamint a TIMP-1 emelkedett szintje már bizonyítást nyert.[112][114][115] Állatokon, valamint sejtkultúrákon végzett kísérletek szerint az MMP enzimek gátlása megszüntette a rák növekedését, gátolta az angiogenezist, valamint fokozta annak elszigetelődését.[112]

A Batimastat nevű MMP inhibítor in vitro körülmények között gátolta a rákos hasnyálmirigysejtek osztódását. Batimastattal kezelt kísérleti egerekben a hasnyálmirigyrák tömegének és kiterjedésének csökkenését, valamint megnövekedett túlélési időt regisztráltak.[112]
Az urokináz típusú plazminogén aktivátor (Urokinase-Type Plasminogen Activator, uPA) egy szerin proteáz, ami az inaktív plazminogént biológiailag aktív plazminná alakítja.[112][116] A plazmin az ECM különböző komponenseit (fibrin, fibronektin, laminin és IV-es típusú kollagén) képes lebontani.[112][117] Ha az uPa a sejtek felszínén megtalálható ciszteinben gazdag urokináz receptorhoz (uPAR) kötődik, akkor enzimatikus aktivitása fokozódik, valamint meghatározza a proteolízis térbeli helyzetét is (közvetlenül a sejtek körüli tér), elősegítve ezzel a rákos sejtek áttétképzését.[112] Egy 76 főt érintő tanulmány a vizsgálatba bevont személyek 78%-ában az uPA és az uPAR 4–6-szoros szintjét mérte a kontroll értékhez képest. Ma már bizonyított, hogy ez az enzim fokozott aktivitással bír hasnyálmirigyrákban.[118] Egy másik felmérés szerint, míg a fokozott uPA szekrécióval bíró páciensek posztoperatív átlagos túlélési ideje kilenc hónap volt, addig az uPA, vagy uPAR faktor negatív betegek átlagos túlélési ideje ennek a duplájára rúgott.[112]
A daganat per continuatem beszűri a környező képleteket, mint a gyomrot, a peritóneumot és a ligamentum hepatoduodenalét. Lymphogen terjedés révén ráterjed a peripancreaticus nyirokcsomókat, haematogén szóródás révén a májba, a tüdőbe és a csontokba ad áttétet.
Diagnózis[szerkesztés]
A beteg fizikális vizsgálata[szerkesztés]
A legtöbb hasnyálmirigyrákos beteg fájdalomra, sárgaságra és fogyásra panaszkodik.[119]
A közeli vagy távoli áttétes betegek 80–85%-ában jelentkezik a hátba sugárzó fájdalom, amely lehet időszakos, vagy jelentkezhet táplálkozást követően. A fogyás étvágycsökkenéssel (anorexia), hasmenéssel (diarrhea) és zsírszéklettel (steatorrhea) jelentkezhet. A sárgaságot (icterus) viszketés és sötét vizelet kíséri. Az icterust fájdalom kíséri a betegek felében, ebben az esetben a daganat valószínűleg nem reszekálható. Fáradtság, ingerlékenység és dysphagia szintén figyelmeztető jel lehet.
Szérum biomarkerek[szerkesztés]
- Az MUC1 egy glikoprotein antigén, amelyet több sejt is szekretál. Rákos folyamatokban e protein megemelkedett szintjét igazolták. Hasnyálmirigyrák diagnosztizálása során szenzitivitása 77%, míg specificitása 95%.[120]
- A Ca 19-9 egy oligoszacharid, amely a legelterjedtebb szérum marker a hasnyálmirigyrákban szenvedő páciens monitorozására, azaz a választott terápia hatékonyságának figyelemmel kísérésére. Mivel a szérum Ca 19-9 szint benignus elváltozásokban is emelkedett, mérése diagnózis felállítására nem javasolt.> Szenzitivitása 70–95%, specificitása 72–90%.[120]
- Az MUC4 markert kizárólag hasnyálmirigy-adenokarcinómák termelik. Felhasználásával kapcsolatban jelenleg is kutatások folynak.[120]
- A CEACAM1 gén fokozott kifejeződése bizonyítást nyert hasnyálmirigyrákban szenvedőkben. Nem megbízhatóbb, mint a Ca 19-9, de együttes monitorozásuk növeli a hasnyálmirigyrák elkülönítésének esélyét a krónikus hasnyálmirigy-gyulladástól.[120]
- A transforming growth factor-Β családba tartozó MIC-1 szérum szintje emelkedett hasnyálmirigyrákos betegekben. Sokkal érzékenyebb marker, mint a Ca 19-9, viszont kevésbé specifikus: jelenléte bizonyítást nyert vastagbél-, gyomor- és emlőrákban is.[120]
Műszeres vizsgálatok[szerkesztés]

- Hagyományos radiológiai vizsgálatok[121]
- Transzabdominális UH vizsgálatok (UH-vezérelt percutan tűbiopszia, endoszkópos UH-vizsgálat)[121]
- Kontrasztanyaggal végzett CT-vizsgálat (különösen a spirál-CT)[121]
- Endoszkópos retrográd cholangiopancreatographia (ERCP)[121]
- Szelektív angiográfia[121]
- PET[121]
- Hasi MRI[120]
- Hasi CT[121]
- Laporoszkópos vizsgálat[121]
Terápia[szerkesztés]
A hasnyálmirigyrák gyógyíthatóságát, valamint a kivitelezhető beavatkozást a primer tumor kiterjedése, nagysága, valamint az áttétek jelenléte határozza meg.[122][123] Ezek a következők:[124]
| Stádium | A rák kiterjedése | Az esetek %-os megoszlása | Lehetséges terápia | Átlagos túlélés |
|---|---|---|---|---|
| I–II | Az elváltozás a hasnyálmirigyre lokalizált | 10% | Radikális műtét; kemo- és/vagy sugárterápia műtétet követően | 17 hónap |
| III | Előrehaladott helyi terjedés; az elváltozás komprimálja a környező ereket, és benyomul a határos szervek állományába | 30% | Radikális műtét nem kivitelezhető; kemo- és/vagy sugárterápia (Egyes esetekben a kezelésre pozitívan reagáló elváltozás alkalmassá válhat sebészi beavatkozásra) | 8–9 hónap |
| IV | A rák távoli áttéteket ad | 60% | Radikális műtét nem kivitelezhető; kemoterápia | 4–6 hónap |
Sebészi beavatkozás[szerkesztés]
Az irányadó sebészi eljárás lokalizált, műtéttel eltávolítható elváltozások esetében a pancreaticoduodenectómia, aminek során a hasnyálmirigy feje, a patkóbél, a közös epevezeték, valamint az epehólyag eltávolításra kerül. A beavatkozás járhat a gyomor antrumának eltávolításával, illetve annak megőrzésével. A manapság alkalmazott, eredetileg két műtétből álló eljárást Allen Oldfather Whipple iráni származású amerikai orvos dolgozta ki 1935-ben. 1941-re összesen 41 pancreaticoduodenectómiát hajtottak végre világszerte. A ma már alacsony mortalitással bíró (átlagosan kevesebb, mint 2%) beavatkozást korábban magas, 30%-os mortalitás jellemezte, amely elsősorban a pancreaticojejunostomia kialakításának hiánya miatt következett be. 1941-ben azonban Whipple módosította az eljárást: a két lépcsős műtétet redukálta egyre, valamint bevezette a pancreaticojejunostomia kialakítását is.[125] A nemzetközi TNM stádiumbeosztás alapján a T1 állapot a legtökéletesebb a sikeres radikális műtét és az ezzel járó hosszútávú túlélés szempontjából.[123] Sajnálatos módon a betegek 70–80%-ában a diagnózis felállításakor az elváltozás előrehaladott, áttétes állapotban van, így mindössze 15–20%-uk alkalmas a radikális sebészi beavatkozásra.[126] Amennyiben a tumor előrehaladott állapota miatt a radikális műtét nem kivitelezhető, csak a palliatív műtét jöhet szóba, mint sebészi beavatkozás.[123] Radikális műtéten átesett egyének átlagban 17 hónapos túlélési idővel bírnak. A rák kiújulása (helyi, és/vagy távoli gócok) a műtétet követően gyakori, amely a betegek 50%-ában a hasnyálmirigyre, illetve a májra, míg 25%-ukban a hasfalra lokalizált.[125]
| pT | Primer tumor |
|---|---|
| pTX | Primer tumor nem ítélhető meg |
| pT0 | Nincs primer tumor |
| pTis | Carcinoma in situ |
| pT1 | A tumor mérete ≤ 2 cm; Tumor a hasnyálmirigyen belül |
| pT2 | A tumor mérete > 2 cm; Tumor a hasnyálmirigyen belül |
| pT3 | A tumor a peripancreatikus térségben jelen van |
| pT4 | A primer tumor beszűri a környező képleteket (Truncus coeliacus, A. mesenterica sup., V. lienalis, V. portae, V. cava inferior) |
| pN | Regionális nyirokcsomók érintettsége |
| pNX | Regionális nyirokcsomó nem ítélhető meg |
| pN0 | A nyirokcsomókban nincs áttét |
| pN1 | Regionális nyirokcsomóáttét |
| pN2 | Távoli nyirokcsomókban áttét |
| pM | Távoli áttétek |
| pMX | Távoli áttét nem állapítható meg |
| pM0 | Távoli áttétek nincsenek |
| pM1 | Távoli áttétek kimutathatóak |
Radikális műtétek[szerkesztés]
A radikális beavatkozás csak abban az esetben eszközölhető, ha az elváltozás a hasnyálmirigy fejére lokalizálódott:
- Totális pancreatectomia során a hasnyálmirigy egész fejét, a vena portaeig bezáróan, valamint a patkóbelet (duodenum) is eltávolítják. Amennyiben a rák már a v. portaet is beszűri, akkor a v. portae reszekcióját is elvégzik. Az arteria coeliacia környéki nyirokcsomók eltávolítása is megtörténik.[123]
- Részleges pancreatoduodenectomia (más néven pancreaticoduodenectomia, pancreatoduodenectomia, Whipple-procedúra, Kausch-Whipple-procedúra).[123] A beavatkozás során a gyomor egy részét (pylorus), a hasnyálmirigy fejét, a közös epevezetéket, az epehólyagot valamint a patkóbelet is eltávolítják.[127] A keletkező gyomorcsonkot anasztomizálják a jejunummal (gastrojejunostomia létrehozása), majd a hasnyálmirigycsonkot is a jejunumba szájaztatják (pancreatojejunostomia).[127]
- Pylorusmegtartásos pancreatoduodenectomia, más néven Flautner-procedúra, illetve Traverso–Longmire-procedúra (PPPD) alkalmazása során a Whipple-procedúrával ellentétben a gyomor érintetlen marad, a hasnyálmirigycsonkot a gyomorba, és nem a jejunumba szájaztatják.[127] Az eljárás előnye, hogy a normális gyomorürülés fennmarad.[128] Kizárólag akkor alkalmazható, ha a rák nem érinti a gyomrot és a környéki nyirokcsomókat.[129]
- Disztális pancreatectomiát diffúzan, vagy disztálisan, azaz a hasnyálmirigy farkában elhelyezkedő rák esetében eszközölnek. A műtét során a lépet is eltávolítják (splenectomia).[123]
Palliatív műtétek[szerkesztés]
A hasnyálmirigyrákos betegek jelentős hányadában (80%) a primer daganat lokális terjedése, valamint kiterjedt távoli áttétek jelenléte miatt nem távolítható el.[123][126] Ilyen esetekben, amikor a kuratív sebészi beavatkozásnak nincs esélye, azaz a teljes gyógyulás nem lehetséges, palliatív sebészi beavatkozás jön szóba, mint egyetlen megmaradt lehetőség.[123] A műtét célja tehát az életminőség javítása, a fellépő tünetek enyhítése. A hasnyálmirigy fejében lévő daganat okozta epeút- és vékonybél-elzáródásokat choledochojejunostomiával, choledochoduodenostomiával, valamint bypassműtéttel orvosolják.[123][126] Ha a beteg kimutatott távoli áttétekkel rendelkezik, akkor az epe szabad elfolyását – és így a sárgaság megszüntetését – drenázzsal, illetve fémstent protézisek percután, vagy endoszkópos behelyezésével biztosítják.[126][130] A csillapíthatatlan fájdalom időleges enyhítésére a ganglion coeliacum blokádja is kivitelezhető.[126][130] Ez később percután módszerrel megismételhető.[130]
Posztoperatív kezelés (adjuváns terápiák)[szerkesztés]
Az évek során több próbálkozás is történt a betegek túlélésének javítása érdekében. A posztoperatívan alkalmazott sugárkezelés a túlélést 5–8 hónappal is megnövelheti.[130] A műtét után indított kemoterápia, mint adjuváns beavatkozás jelentősen növeli az 5 éves túlélés esélyét.[131] A mindezidáig alkalmazott szerek, mint a fluorouracyl valamint a mitomicyn C nem váltották be a hozzájuk fűzött reményeket, ám az utóbbi időben használt gemcitabin hatására a túlélés 5–11%-kal is növekedhet.[130][132]
Kemoterápia[szerkesztés]
Amennyiben a sebészi kezelés nem megvalósítható, a kemoterápia, mint palliatív kezelés jön szóba. Ebben az esetben az elsődleges cél a beteg életminőségének javítása.
Gyógynövények[szerkesztés]
Újabban, a Coloradoi Rákkutató Központ egereken végzett tanulmánya szerint a balzsamkörte (Momordica charantia) kivonatának jótékony hatása lehet a hasnyálmirigyrák elleni harcban.[133]
Megelőzés[szerkesztés]
Az American Cancer Society (ACS) véleménye szerint nincs biztos módszer a hasnyálmirigyrák megelőzésére, habár biztosnak vehető, hogy a dohányzás primer okként szerepel a kialakult daganatos esetek 20–30%-ában.[134]
Az ACS javasolja az egészséges testsúlyt, a zöldség- és gyümölcsfélék mindennapi fogyasztását, illetve a túlzott húsfogyasztás mellőzését.[135][136]
A fokozott D-vitamin-bevitel 50%-kal is csökkentheti a hasnyálmirigyrák (és egyéb tumorok) kialakulásának kockázatát.[137][138][139] Egy 2007-es kutatás szerint a B-vitaminok, mint a B12 és B6 (kizárólag a táplálékkal bevitt formák, a B-vitamintabletták nem) szintén gátolják a rák kialakulását.[140][141]
Kapcsolódó szócikkek[szerkesztés]
Megjegyzés[szerkesztés]
- ↑ A rák teljes remissziója.
- ↑ Mirigyhámból kiinduló rák, adenokarcinóma.
- ↑ Mortalitás. Megmutatja, hogy az adott betegségre vonatkoztatva, 100 000 lakosból egy év alatt hány halálozik el.
- ↑ A kivezetőcsövekből kiinduló (duktális) adenokarcinómák.
- ↑ Bélfodri/zsigeri artériák = mesenterialis .
- ↑ Váltakozó, más és más helyen fellépő vénagyulladás trombózissal kísérve.
- ↑ 5'-nukleotidáz (5'-NT); egy fehérje, amelyet a máj termel. Egyes daganatos megbetegedésekben a vérben mérhető szintje megemelkedik.
- ↑ Laktát dehidrogenáz (LDH, LD); egy széles körben elterjedt enzim, amely a laktát piruváttá történő oxidációjáért is felelős.
- ↑ Aszpartát aminotranszferáz (AST); egy enzim, amely nagy mennyiségben fordul elő a szívizomban és a májban.
- ↑ Alfa-foetoprotein (AFP); fehérje, amelynek szintje magas lehet daganatos megbetegedésekben, valamint terhességben a velőcső záródási megbetegedése esetén is.
- ↑ Súlyos malignitást megelőző állapot.
- ↑ Pre invazív: a betegség súlyos, nagy malignitással bíró állapota.
- ↑ Hiperplázia; a szövet illetve szerv megnagyobbodása, amelyet sejtszaporulat és sejttömeg-növekedés vált ki.
- ↑ Metaplázia: egy érett sejttípus helyén egy másik sejttípus jelenik meg.
- ↑ Diszplázia: körülhatároltan jelentkező sejtszaporulat, amelyet szövettanilag atípusos sejtek alkotnak.
- ↑ Atipikus: nem normális szövetszerkezet.
- ↑ Tumorszupresszor gének: azon gének, amelyek olyan fehérjéket kódolnak, amelyek elnyomják a mitózist és a sejtnövekedést.
- ↑ Növekedési faktorok; sejtek által termelt és ürített fehérjék, amelyek sejtosztódást befolyásoló gének aktivációját idézik elő.
- ↑ Biszfenol A-nevű kemikália megtalálható többek között a szemüveglencsék, digitális médiahordozók (CD, DVD-k), elektromos eszközök (pl.: mobiltelefonok, számítógépek, háztartási eszközök), sport és ipari védőfelszerelések, autóalkatrészek, egyes fogtömésekben, polikarbonát műanyagból készült étel- és ital tárolására használatos edényekben (pl. cumisüvegek, palackok, ételhordók, műanyag tányérok, mikrohullámú készülékekben használt edények, vízvezeték csövek stb.), valamint fenoplaszt gyantákban, epoxigyantákban is, utóbbiakat a fém konzervdobozok, tárolóedények (pl. ivóvizes, bortartályok) belső felületének bevonására használnak, a PVC műanyagokban és hőpapírokban (pl. bankártyás fizetési bizonylat és egyes bolti bizonylatok), illetve a tetrabróm-BpA nevű lánggátlóban, valamint annak bomlástremékeiben, orvosi eszközökben (csövekben, műanyag eszközökben, fogászati kompozitokban), autógumikban, fékfolyadékokban.
- ↑ Örökletes nem polipózus kolorektális karcinóma
- ↑ Herediter (örökletes) dysplasiás naevus-szindróma
- ↑ Familiáris adenomatózus polipózis
- ↑ Ataxia telangiectasia
- ↑ Reaktív intermedier vegyületek: nagy aktivitással bíró, azonnal tovább reagáló köztes termékek.
- ↑ Per os: latin kifejezés, jelentése „szájon át”.
- ↑ Sonic hedgehog (SHH); az emlősökben előforduló 3 hedgehog jelösvény egyik képviselője.
- ↑ Antagonista; ellentétes hatású.
- ↑ Gasztroenterikus; azaz emésztőszervrendszeri.
- ↑ Karcinogenezis: rákos sejtek, szövetek képződésének összetett folyamata.
Jegyzetek[szerkesztés]
- ↑ a b c Pancreatic Cancer (angol nyelven). cancer.gov, 2010. (Hozzáférés: 2011. május 25.)
- ↑ World Health Organization; Cancer; Pancreas. (Hozzáférés: 2009. október 25.)
- ↑ Pancreatic Cancer Statistics: Survival Rates. Arthur Schoenstadt, MD, 2006. november 6. (Hozzáférés: 2009. október 25.)
- ↑ a b c d e f g h i j k l m n o p q r s t u v w McPhee, Stephen J.. Pathophysiology of disease: an introduction to clinical medicine (angol nyelven). Norwalk, CT: Appleton & Lange, 371-372. o. (1997). ISBN 0-8385-7678-8
- ↑ a b Cotran, Ramzi S.; Kumar, Vinay; Fausto, Nelson; Nelso Fausto; Robbins, Stanley L.; Abbas, Abul K.. 19 The pancreas, neoplasms, Robbins and Cotran pathologic basis of disease, 7. kiadás (angol nyelven), St. Louis, Mo: Elsevier Saunders, 947-954. o. (2005). ISBN 0-7216-0187-1. Hozzáférés ideje: 2009. október 27.
- ↑ Ghaneh P, Costello E, Neoptolemos JP (2007). „Biology and management of pancreatic cancer” (angol nyelven). Gut 56 (8), 1134–52. o. DOI:10.1136/gut.2006.103333. PMID 17625148.
- ↑ Types of Pancreatic Cancer. Arthur Schoenstadt, MD, 2008. október 23. (Hozzáférés: 2009. október 25.)
- ↑ Yao JC, Eisner MP, Leary C, Dagohoy C, Phan A, Rashid A, Hassan M, Evans DB (2007. December). „Population-based study of islet cell carcinoma” (angol nyelven). Annals of Surgical Oncology 14 (12), 3492–500. o. DOI:10.1245/s10434-007-9566-6. PMID 17896148. (Hozzáférés: 2010. július 3.)
- ↑ Hasnyálmirigyrák. (Hozzáférés: 2009. október 25.)
- ↑ WHO Disease and injury country estimates, 2009. (Hozzáférés: 2009. november 11.)
- ↑ a b c d e Ghadirian P, Lynch HT, Krewski D (2003). „Epidemiology of pancreatic cancer: an overview”. Cancer Detection and Prevention 27 (2), 87–93. o. PMID 12670518. (Hozzáférés: 2010. augusztus 15.)
- ↑ Devesa et al.: Recent Cancer Trends in the United States -- JNCI Journal of the National Cancer Institute (angol nyelven) pp. 175-182. Oxford Journals. (Hozzáférés: 2010. július 3.)
- ↑ a b Ahlgren JD (1996. April). „Epidemiology and risk factors in pancreatic cancer” (angol nyelven). Seminars in Oncology 23 (2), 241–50. o. PMID 8623060. (Hozzáférés: 2010. július 3.)
- ↑ Niederhuber JE, Brennan MF, Menck HR (1995. November). „The National Cancer Data Base report on pancreatic cancer” (angol nyelven). Cancer 76 (9), 1671–7. o. PMID 8635074. (Hozzáférés: 2010. július 3.)
- ↑ a b c d Yamada, Tadataka. 47., E PANCREAS, Atlas of Gastroenterology, negyedik kiadás (angol nyelven), Wiley-Blackwell (2009). ISBN 1-4051-6909-5
- ↑ a b c Zelenetz, Andrew D.; Kelsen, David; Yuman Fong; Gerdes, Hans; Daly, John Charles; Scott E Kern; Greaves, Mark; Levin, Bernard; Klimstra, David S.; Tepper, Joel E.; Markowitz, Arnold L.; Offit, Kenneth; Saltz, Leonard B.. 24., Pancreas Cancer: Epidemiology and Risk Factors, Principles and practice of gastrointestinal oncology, második kiadás (angol nyelven), Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins (2008). ISBN 0-7817-7617-1
- ↑ a b Tominaga S, Kuroishi T (1998). „<3::AID-SSU2>3.0.CO;2-9 Epidemiology of pancreatic cancer” (angol nyelven). Seminars in Surgical Oncology 15 (1), 3–7. o. PMID 9671950. (Hozzáférés: 2010. július 3.)
- ↑ a b Warshaw AL, Fernández-del Castillo C (1992. February). „Pancreatic carcinoma”. The New England Journal of Medicine 326 (7), 455–65. o. PMID 1732772. (Hozzáférés: 2010. július 19.)
- ↑ a b c Yamada, Tadataka. 54., Pancreatic Adenocarcinoma, Handbook of gastroenterology, Második kiadás (angol nyelven), Hagerstwon, MD: Lippincott Williams & Wilkins (2005). ISBN 0-7817-5460-7
- ↑ a b Jaffer A. Ajani; McCulloch, Peter B.; Martin Karpeh; Kerr, David N. S.. Gastrointestinal oncology: evidence and analysis (angol nyelven). Informa Healthcare, 219. o. (2007). ISBN 0-8493-9865-7
- ↑ Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000. The global picture. Eur J Cancer 2000; 37: S4-S66.
- ↑ Fernandez E, La Vecchia C. Porta M et al. Trends in pancreatic cancer mortality in Europe. Int J Cancer 1994; 57: 786-92.
- ↑ Cancer Statistics in Japan 2001. In: Foundation for the Promotion of Cancer Research. Tokyo: National Cancer Center, 2001: www.ncc.go.jp
- ↑ Gold EB, Goldin SB (1998. January). „Epidemiology of and risk factors for pancreatic cancer”. Surgical Oncology Clinics of North America 7 (1), 67–91. o. PMID 9443987. (Hozzáférés: 2010. augusztus 15.)
- ↑ a b c d e Peter W. T. Pisters; Evans, Douglas; Brennan, Murray F; James L. Abbruzzese; Eileen O'Reilly. 1. Molecular Epidemiology, Pancreatic cancer (angol nyelven). Berlin: Springer (2002). ISBN 0-387-95185-7
- ↑ European Cancer Observatory: Cancer Fact Sheets; Cancer: Pancreas. ECO. [2009. május 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. június 29.)
- ↑ Négyféle genetikai hiba okozhatja a hasnyálmirigyrákot. Index.hu. (Hozzáférés: 2015. február 25.)
- ↑ a b c d e f g h i j k l m n o p What You Need To Know About Cancer of the Pancreas - National Cancer Institute, 2002. szeptember 16. [2007. október 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 22.)
- ↑ 17 The Pancreas, Robbins Basic Pathology, 8th Edition, 8th (angol nyelven), Saunders, 675. o. (2007). ISBN 9781416029731. Hozzáférés ideje: 2009. október 27. „"...location of the pancreas and the generally vague signs and symptoms associated with its injury allow many pancreatic diseases to progress undiagnosed for extended periods of time..."”
- ↑ a b c d e f g h i j k l Andersson A, Bergdahl L (1976. March). „Carcinoma of the pancreas”. The American Surgeon 42 (3), 173–7. o. PMID 1259248. (Hozzáférés: 2010. július 19.)
- ↑ a b c d e f g h i j k l Hines LH, Burns RP (1976. June). „10 years' experience treating pancreatic and periampullary cancer”. The American Surgeon 42 (6), 441–7. o. PMID 59561. (Hozzáférés: 2010. július 19.)
- ↑ a b c d e f g h Fitzgerald PJ et al: The value of diagnostic aide in detecting pancreas cancer. Cancer 1978;41:969
- ↑ a b c Petersen, Gloria M. (2016). „Abstract IA03: Genetic and non-genetic risk factors of pancreatic cancer” (angol nyelven). American Association for Cancer Research, IA03-IA03. o. DOI:10.1158/1538-7445.PANCA16-IA03.
- ↑ a b Midha, S., Chawla, S., & Garg, P. K. (2016). „Modifiable and non-modifiable risk factors for pancreatic cancer: A review.” (angol nyelven). Cancer Letters 381 (1), 269-277. o. DOI:10.1016/j.canlet.2016.07.022. PMID 27461582.
- ↑ a b Silverman, Debra T. (2001). „Risk factors for pancreatic cancer: A case‐control study based on direct interviews” (angol nyelven). Teratogenesis, carcinogenesis, and mutagenesis 21 (1), 7-25. o.
- ↑ a b c d e f g Kopper, Schaff & Illyés 2006, p. 890
- ↑ Zalatnai, Attila. A familiáris hasnyálmirigyrák [archivált változat]. Budapest: Magyar Onkológia 50. évfolyam, 163-168. o. (2006) [archiválás ideje: 2014. március 7.]
- ↑ The Genetics of Pancreatic Cancer [archivált változat]. American Society of Clinical Oncology (2008) [archiválás ideje: 2010. június 26.]
- ↑ a b Kopper, Schaff & Illyés 2006, p. 889
- ↑ Overview of the Molecular Biology of Pancreatic Cancer. Cancer GeneticsWeb. (Hozzáférés: 2010. június 22.)
- ↑ a b c d e f David Lowell Strayer; Raphael Rubin; Rubin, Emanuel. 15, The Pancreas: Pancreatic Cancer, Rubin's pathology: clinicopathologic foundations of medicine, Ötödik, bővített kiadás (angol nyelven), Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins (2008). ISBN 0-7817-9516-8
- ↑ Harrison, Tinsley Randolph; Chabner, Bruce; Lynch, Thomas Dexter; Longo, Dan L.. 11, GI Oncology Pancreatic Cancer, Harrison's manual of oncology, 1. kiadás (angol nyelven), New York: McGraw-Hill Medical Pub. Division. DOI: 10.1036/0071411895 (2008). ISBN 0-07-141189-5
- ↑ a b c d e f g h i j k l m n o ACS :: What Are the Risk Factors for Cancer of the Pancreas?. [2007. október 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. december 13.)
- ↑ a b Silverman DT, Dunn JA, Hoover RN, Schiffman M, Lillemoe KD, Schoenberg JB, Brown LM, Greenberg RS, Hayes RB, Swanson GM (1994. October). „Cigarette smoking and pancreas cancer: a case-control study based on direct interviews” (angol nyelven). Journal of the National Cancer Institute 86 (20), 1510–6. o. PMID 7932805. (Hozzáférés: 2010. július 3.)
- ↑ Fucic, A., Gamulin, M., Ferencic, Z., Katic, J., von Krauss, M. K., Bartonova, A., & Merlo, D. F. (2012). „Environmental exposure to xenoestrogens and oestrogen related cancers: reproductive system, breast, lung, kidney, pancreas, and brain” (angol nyelven). Environmental Health 11 (1), S8. o. DOI:10.1186/1476-069X-11-S1-S8. PMID 22759508.
- ↑ Oláh Eszter: Klórozott szénhidrogén típusú növényvédõszerek (magyar nyelven). Krata Kft, 2009 [2017. február 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2017. február 11.)
- ↑ Antwi, S. O., Eckert, E. C., Sabaque, C. V., Leof, E. R., Hawthorne, K. M., Bamlet, W. R., et al. & Petersen, G. M. (2015). „Exposure to environmental chemicals and heavy metals, and risk of pancreatic cancer.” (angol nyelven). Cancer Causes & Control 26 (11), 1583-1591. o. DOI:10.1007/s10552-015-0652-y. PMID 26293241.
- ↑ García-Esquinas, E., Pollan, M., Tellez-Plaza, M., Francesconi, K. A., Goessler, W., Guallar, E., et al. and Navas-Acien, A. (2014). „Cadmium exposure and cancer mortality in a prospective cohort: the strong heart study” (angol nyelven). Environmental health perspectives 122 (4), 363. o. DOI:10.1289/ehp.1306587.
- ↑ http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2817931/#R11
- ↑ Archivált másolat. [2017. február 20-i dátummal az eredetiből archiválva]. (Hozzáférés: 2017. február 19.)
- ↑ Archivált másolat. [2016. március 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2017. február 19.)
- ↑ Cuomo, D., Porreca, I., Cobellis, G., Tarallo, R., Nassa, G., Falco, G., ... & Ambrosino, C. (2017). „Carcinogenic risk and Bisphenol A exposure: A focus on molecular aspects in endoderm derived glands” (angol nyelven). Molecular and Cellular Endocrinology. DOI:10.1016/j.mce.2017.01.027. PMID 28111205.
- ↑ Alonso-Magdalena, P., Morimoto, S., Ripoll, C., Fuentes, E., & Nadal, A. (2006). „The estrogenic effect of bisphenol A disrupts pancreatic β-cell function in vivo and induces insulin resistance” (angol nyelven). Environmental health perspectives 114, 106-112.. o. DOI:PMC1332664. PMID 16393666.
- ↑ a b Lin, Y., Sun, X., Qiu, L., Wei, J., Huang, Q., Fang, C., Dong, S. et al. (2013). „Exposure to bisphenol A induces dysfunction of insulin secretion and apoptosis through the damage of mitochondria in rat insulinoma (INS-1) cells” (angol nyelven). Cell death & disease 4 (1). DOI:10.1038/cddis.2012.206. PMID 23328667.
- ↑ Lang IA, Galloway TS, Scarlett A, Henley WE, Depledge M, Wallace RB et al. (2008). „Association of urinary bisphenol A concentration with medical disorders and laboratory abnormalities in adults” (angol nyelven). JAMA 300 (11), 1303–1310. o. DOI:10.1001/jama.300.11.1303. PMID 18799442.
- ↑ Fenichel, P., Chevalier, N., & Brucker-Davis, F. (2013). „Bisphenol A: an endocrine and metabolic disruptor.” (angol nyelven). In Annales d'endocrinologie 74 (3), 211-220. o. DOI:10.1016/j.ando.2013.04.002. PMID 23796010.
- ↑ Vándorfi Gy., Urich E. (2006). „A pancreas béta-sejtjeinek diszfunkciója és protekciója 2-es típusú cukorbetegségben” (magyar nyelven). LAM (Lege Artis Medicinæ) 16 (5), 401. o. [halott link]
- ↑ Selenskas, S., Teta, M. J., & Vitale, J. N. (1995). „Pancreatic cancer among workers processing synthetic resins” (angol nyelven). American journal of industrial medicine 28 ((3),), 385-398.. o. PMID 7485192.
- ↑ Pensabene, J. W., Fiddler, W., Gates, R. A., Fagan, J. C., & Wasserman, A. E. (1974). „Effect of frying and other cooking conditions on nitrosopyrrolidine formation in bacon.” (angol nyelven). Journal of food science 39 (2), 314-316.. o. DOI:10.1111/j.1365-2621.1974.tb02883.x.
- ↑ Monte, S.: Nitrózamin generáció lettünk? (magyar nyelven). Magyar Orvosi Kamara, 2009. július 17. (Hozzáférés: 2017. február 11.)
- ↑ Pour, P., Krüger, F. W., Althoff, J., Cardesa, A., & Mohr, U. (1974). „Cancer of the Pancreas Induced in the Syrian Golden Hamster” (angol nyelven). The American journal of pathology 76 (2), 349. o. PMID 4367264.
- ↑ Fritschi, L., Benke, G., Risch, H. A., Schulte, A., Webb, P. M., Whiteman, D. C., et al. & Neale, R. E. (2015). „Occupational exposure to N-nitrosamines and pesticides and risk of pancreatic cancer.” (angol nyelven). Occupational and environmental medicine. DOI:10.1136/oemed-2014-102522.
- ↑ Anttila, A., Pukkala, E., Sallmén, M., Hernberg, S., & Hemminki, K. (1995). „Cancer incidence among Finnish workers exposed to halogenated hydrocarbons” (angol nyelven). Journal of Occupational and Environmental Medicine 37 (7), 797-806. o. PMID 7552463.
- ↑ Red Meat May Be Linked to Pancreatic Cancer. Journal of the National Cancer Institute. WebMD, 2005. október 5. (Hozzáférés: 2008. március 5.)
- ↑ Larsson, S. C., & Wolk, A. (2012). „Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies.” (angol nyelven). British journal of cancer 106 (3), 603-607. o. DOI:doi:10.1038/bjc.2011.585. PMID 22240790.
- ↑ Obesity Linked to Pancreatic Cancer. American Cancer Society. Cancer Epidemiology, Biomarkers & Prevention (Vol. 14, No. 2: 459-466), 2005. március 6. [2008. február 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 5.)
- ↑ Berrington de Gonzalez A, Sweetland S, Spencer E (2003. August). „A meta-analysis of obesity and the risk of pancreatic cancer”. British Journal of Cancer 89 (3), 519–23. o. DOI:10.1038/sj.bjc.6601140. PMID 12888824. (Hozzáférés: 2010. augusztus 10.)
- ↑ Patel AV, Rodriguez C, Bernstein L, Chao A, Thun MJ, Calle EE (2005. February). „Obesity, recreational physical activity, and risk of pancreatic cancer in a large U.S. Cohort”. Cancer Epidemiology, Biomarkers & Prevention : a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology 14 (2), 459–66. o. DOI:10.1158/1055-9965.EPI-04-0583. PMID 15734973. (Hozzáférés: 2010. augusztus 10.)
- ↑ Silverman, D. T. (2001). „Risk factors for pancreatic cancer: A case-control study based on direct interviews” (angol nyelven). Teratogenesis, carcinogenesis, and mutagenesis 21 (1), 7-25. o. DOI:<7::AID-TCM3>3.0.CO;2-A 10.1002/1520-6866(2001)21:1<7::AID-TCM3>3.0.CO;2-A. PMID 11135318.
- ↑ Bosetti, C., Bravi, F., Turati, F., Edefonti, V., Polesel, J., Decarli, A., et al. & Zeegers, M. P. (2013). „Nutrient-based dietary patterns and pancreatic cancer risk” (angol nyelven). Annals of epidemiology 23 (3), 124-128. o. DOI:10.1016/j.annepidem.2012.12.005.. PMID 23332711.
- ↑ Body Mass Index and Risk, Age of Onset, and Survival in Patients With Pancreatic Cancer Donghui Li, PhD; Jeffrey S. Morris, PhD; Jun Liu, MS; Manal M. Hassan, MD, PhD; R. Sue Day, PhD; Melissa L. Bondy, PhD; James L. Abbruzzese, MD JAMA. 2009;301(24):2553-2562.
- ↑ a b Chan JM, Wang F, Holly EA (2005. September). „Vegetable and fruit intake and pancreatic cancer in a population-based case-control study in the San Francisco bay area” (angol nyelven). Cancer Epidemiology, Biomarkers & Prevention : a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology 14 (9), 2093–7. o. DOI:10.1158/1055-9965.EPI-05-0226. PMID 16172215. (Hozzáférés: 2009. január 14.)
- ↑ Silverman DT, Swanson CA, Gridley G, Wacholder S, Greenberg RS, Brown LM, Hayes RB, Swanson GM, Schoenberg JB, Pottern LM, Schwartz AG, Fraumeni JF, Hoover RN (1998. November). „Dietary and nutritional factors and pancreatic cancer: a case-control study based on direct interviews” (angol nyelven). Journal of the National Cancer Institute 90 (22), 1710–9. o. PMID 9827525. (Hozzáférés: 2010. július 3.)
- ↑ a b c d e Baghurst PA, McMichael AJ, Slavotinek AH, Baghurst KI, Boyle P, Walker AM (1991. July). „A case-control study of diet and cancer of the pancreas” (angol nyelven). American Journal of Epidemiology 134 (2), 167–79. o. PMID 1862800. (Hozzáférés: 2010. július 3.)
- ↑ a b c d Bueno de Mesquita HB, Maisonneuve P, Runia S, Moerman CJ (1991. June). „Intake of foods and nutrients and cancer of the exocrine pancreas: a population-based case-control study in The Netherlands” (angol nyelven). International Journal of Cancer. Journal International Du Cancer 48 (4), 540–9. o. PMID 1646177. (Hozzáférés: 2010. július 3.)
- ↑ Norell SE, Ahlbom A, Erwald R, Jacobson G, Lindberg-Navier I, Olin R, Törnberg B, Wiechel KL (1986. December). „Diet and pancreatic cancer: a case-control study” (angol nyelven). American Journal of Epidemiology 124 (6), 894–902. o. PMID 3776972. (Hozzáférés: 2010. július 3.)
- ↑ La Vecchia C, Negri E, D'Avanzo B, Ferraroni M, Gramenzi A, Savoldelli R, Boyle P, Franceschi S (1990). „Medical history, diet and pancreatic cancer” (angol nyelven). Oncology 47 (6), 463–6. o. PMID 2243664. (Hozzáférés: 2010. július 3.)
- ↑ a b c d Ji BT, Chow WH, Gridley G, Mclaughlin JK, Dai Q, Wacholder S, Hatch MC, Gao YT, Fraumeni JF (1995. December). „Dietary factors and the risk of pancreatic cancer: a case-control study in Shanghai China” (angol nyelven). Cancer Epidemiology, Biomarkers & Prevention : a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology 4 (8), 885–93. o. PMID 8634662. (Hozzáférés: 2010. július 3.)
- ↑ Wang F, Herrington M, Larsson J, Permert J (2003. January). „The relationship between diabetes and pancreatic cancer” (angol nyelven). Molecular Cancer 2, 4. o. DOI:10.1186/1476-4598-2-4. PMID 12556242. (Hozzáférés: 2010. július 3.)
- ↑ Chari ST, Leibson CL, Rabe KG, Timmons LJ, Ransom J, de Andrade M, Petersen GM (2008. January). „Pancreatic cancer-associated diabetes mellitus: prevalence and temporal association with diagnosis of cancer”. Gastroenterology 134 (1), 95–101. o. DOI:10.1053/j.gastro.2007.10.040. PMID 18061176. (Hozzáférés: 2010. augusztus 10.)
- ↑ H. pylori and Pancreatic Cancer: Fact Sheet, 2002. szeptember 16. [2009. szeptember 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. október 25.)
- ↑ Michaud DS, Joshipura K, Giovannucci E, Fuchs CS (2007. Jan). „A prospective study of periodontal disease and pancreatic cancer in US male health professionals” (angol nyelven) (Free full text). J. Natl. Cancer Inst. 99 (2), 171–5. o. DOI:10.1093/jnci/djk021. ISSN 0027-8874. PMID 17228001.
- ↑ Ganong, William F.; McPhee, Stephen J.; Lingappa, Vishwanath R.. Pathophysiology of disease: an introduction to clinical medicine, 5 (angol nyelven), New York: Lange Medical Books/McGraw-Hill, Medical Pub. Division (2006). ISBN 0-07-144159-X
- ↑ Pancreatic Cancer Causes. Arthur Schoenstadt, MD, 2008. szeptember 10. (Hozzáférés: 2009. október 25.)
- ↑ a b c Pancreatic Cancer Action Network; Risk Factors for pancreatic cancer. (Hozzáférés: 2009. október 25.)
- ↑ What are risk factors for pancreatic cancer?. Johns Hopkins. The Sol Goldman Pancreatic Cancer Research Center. [2009. november 1-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. október 26.)
- ↑ Porta M, Malats N, Guarner L, Carrato A, Rifà J, Salas A, Corominas JM, Andreu M, Real FX (1999. November). „Association between coffee drinking and K-ras mutations in exocrine pancreatic cancer. PANKRAS II Study Group”. Journal of Epidemiology and Community Health 53 (11), 702–9. o. PMID 10656099. (Hozzáférés: 2010. augusztus 8.)
- ↑ Jacobsen BK, Heuch I (2000. September). „Coffee, K-ras mutations and pancreatic cancer: a heterogeneous aetiology or an artefact?”. Journal of Epidemiology and Community Health 54 (9), 654–5. o. PMID 10942442. (Hozzáférés: 2010. augusztus 8.)
- ↑ Kuper HE, Mucci LA, Trichopoulos D (2000. September). „Coffee, pancreatic cancer and the question of causation”. Journal of Epidemiology and Community Health 54 (9), 650–1. o. PMID 10942440. (Hozzáférés: 2010. augusztus 8.)
- ↑ a b c d Mueller NT, Odegaard A, Anderson K, Yuan JM, Gross M, Koh WP, Pereira MA (2010. February). „Soft drink and juice consumption and risk of pancreatic cancer: the Singapore Chinese Health Study” (angol nyelven). Cancer Epidemiology, Biomarkers & Prevention : a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology 19 (2), 447–55. o. DOI:10.1158/1055-9965.EPI-09-0862. PMID 20142243. (Hozzáférés: 2010. július 4.)
- ↑ Nöthlings, U., Wilkens, L. R., Murphy, S. P., Hankin, J. H., Henderson, B. E., & Kolonel, L. N. (2005). „Meat and fat intake as risk factors for pancreatic cancer: the multiethnic cohort study” (angol nyelven). Journal of the National Cancer Institute 97 (19), 1458-1465. o. DOI:10.1093/jnci/dji292. PMID 16204695.
- ↑ National Institute on Alcohol Abuse and Alcoholism Alcohol and Cancer - Alcohol Alert No. 21-1993 Archiválva 2005. december 23-i dátummal a Wayback Machine-ben
- ↑ American Cancer Society Coffee and Alcohol Do Not Pose a Risk for Pancreatic Cancer Archiválva 2009. április 14-i dátummal a Wayback Machine-ben
- ↑ Villeneuve PJ, Johnson KC, Hanley AJ, Mao Y (2000. February). „Alcohol, tobacco and coffee consumption and the risk of pancreatic cancer: results from the Canadian Enhanced Surveillance System case-control project. Canadian Cancer Registries Epidemiology Research Group” (angol nyelven). European Journal of Cancer Prevention : the Official Journal of the European Cancer Prevention Organisation (ECP) 9 (1), 49–58. o. PMID 10777010. (Hozzáférés: 2010. július 3.) [halott link]
- ↑ Cuzick J, Babiker AG (1989. March). „Pancreatic cancer, alcohol, diabetes mellitus and gall-bladder disease” (angol nyelven). International Journal of Cancer. Journal International Du Cancer 43 (3), 415–21. o. PMID 2925272. (Hozzáférés: 2010. július 3.)
- ↑ Harnack LJ, Anderson KE, Zheng W, Folsom AR, Sellers TA, Kushi LH (1997. December). „Smoking, alcohol, coffee, and tea intake and incidence of cancer of the exocrine pancreas: the Iowa Women's Health Study” (angol nyelven). Cancer Epidemiology, Biomarkers & Prevention : a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology 6 (12), 1081–6. o. PMID 9419407. (Hozzáférés: 2010. július 3.)
- ↑ Fraumeni, Joseph F.; Schottenfeld, David; Marshall, James M.. Cancer epidemiology and prevention, Harmadik kiadás (angol nyelven), Oxford [Oxfordshire]: Oxford University Press (2006). ISBN 0-19-514961-0
- ↑ Ye W, Lagergren J, Weiderpass E, Nyrén O, Adami HO, Ekbom A (2002. August). „Alcohol abuse and the risk of pancreatic cancer” (angol nyelven). Gut 51 (2), 236–9. o. DOI:10.1136/gut.51.2.236. PMID 12117886. (Hozzáférés: 2010. július 3.)
- ↑ Silverman DT, Brown LM, Hoover RN, Schiffman M, Lillemoe KD, Schoenberg JB, Swanson GM, Hayes RB, Greenberg RS, Benichou J (1995. November). „Alcohol and pancreatic cancer in blacks and whites in the United States” (angol nyelven). Cancer Research 55 (21), 4899–905. o. PMID 7585527. (Hozzáférés: 2010. július 3.)
- ↑ Olsen GW, Mandel JS, Gibson RW, Wattenberg LW, Schuman LM (1989. August). „A case-control study of pancreatic cancer and cigarettes, alcohol, coffee and diet” (angol nyelven). American Journal of Public Health 79 (8), 1016–9. o. PMID 2751016. (Hozzáférés: 2010. július 3.)
- ↑ Bueno de Mesquita HB, Maisonneuve P, Moerman CJ, Runia S, Boyle P (1992. February). „Lifetime consumption of alcoholic beverages, tea and coffee and exocrine carcinoma of the pancreas: a population-based case-control study in The Netherlands” (angol nyelven). International Journal of Cancer. Journal International Du Cancer 50 (4), 514–22. o. PMID 1537615. (Hozzáférés: 2010. július 3.)
- ↑ a b c Peter W. T. Pisters; Evans, Douglas; Brennan, Murray F; James L. Abbruzzese; Eileen O'Reilly. Pancreatic cancer (angol nyelven). Berlin: Springer, 1-7. o. (2002). ISBN 0-387-95185-7
- ↑ Berman, D. M.; Karhadkar, S. S.; Maitra, A.; Montes de Oca, R.; Gerstenblith, M. R.; Briggs, K.; Parker, A. R.; Shimada, Y.; Eshleman, J. R.; Watkins, D. N.; Beachy, P. A.: Widespread requirement for hedgehog ligand stimulation in growth of digestive tract tumours. Nature 425: 846-851, 2003.
- ↑ Thayer SP, di Magliano MP, Heiser PW, Nielsen CM, Roberts DJ, Lauwers GY, Qi YP, Gysin S, Fernández-del Castillo C, Yajnik V, Antoniu B, McMahon M, Warshaw AL, Hebrok M (2003. October). „Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis” (angol nyelven). Nature 425 (6960), 851–6. o. DOI:10.1038/nature02009. PMID 14520413. (Hozzáférés: 2010. július 3.)
- ↑ Mutated Genes and Abnormal Protein Expression. www.cancer-genetics.org. (Hozzáférés: 2010. június 22.)
- ↑ a b c d e f g h i j k Peter W. T. Pisters; Evans, Douglas; Brennan, Murray F; James L. Abbruzzese; Eileen O'Reilly. 2, The Molecular Biology of Pancreatic Cancer, Pancreatic cancer (angol nyelven). Berlin: Springer, 15-24. o. (2002). ISBN 0-387-95185-7
- ↑ Veikkola T, Jussila L, Makinen T, et al. (2001. March). „Signalling via vascular endothelial growth factor receptor-3 is sufficient for lymphangiogenesis in transgenic mice” (angol nyelven). The EMBO Journal 20 (6), 1223–31. o. DOI:10.1093/emboj/20.6.1223. PMID 11250889. (Hozzáférés: 2010. július 2.)
- ↑ Kopper, Schaff & Illyés 2006, p. 888
- ↑ a b Kopper, Schaff & Illyés 2006, p. 891
- ↑ a b Kopper, Schaff & Illyés 2006, p. 892
- ↑ a b c d e f g h David Lowell Strayer; Raphael Rubin; Rubin, Emanuel. 15, The Pancreas: Pancreatic Cancer, Rubin's pathology: clinicopathologic foundations of medicine, Ötödik, bővített kiadás (angol nyelven), Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins (2008). ISBN 0-7817-9516-8
- ↑ a b c d e f g h i j k Peter W. T. Pisters; Evans, Douglas; Brennan, Murray F; James L. Abbruzzese; Eileen O'Reilly. 2.The Molecular Biology of Pancreatic Cancer, Pancreatic cancer (angol nyelven). Berlin: Springer, 23. o. (2002). ISBN 0-387-95185-7
- ↑ Kleiner DE, Stetler-Stevenson WG (1999). „Matrix metalloproteinases and metastasis”. Cancer Chemotherapy and Pharmacology 43 Suppl, S42–51. o. PMID 10357558. (Hozzáférés: 2010. július 2.) [halott link]
- ↑ Matsuyama Y, Takao S, Aikou T (2002. June). „Comparison of matrix metalloproteinase expression between primary tumors with or without liver metastasis in pancreatic and colorectal carcinomas”. Journal of Surgical Oncology 80 (2), 105–10. o. DOI:10.1002/jso.10106. PMID 12173379. (Hozzáférés: 2010. július 2.)
- ↑ Gress TM, Müller-Pillasch F, Lerch MM, Friess H, Büchler M, Adler G (1995. August). „Expression and in-situ localization of genes coding for extracellular matrix proteins and extracellular matrix degrading proteases in pancreatic cancer”. International Journal of Cancer. Journal International Du Cancer 62 (4), 407–13. o. PMID 7635566. (Hozzáférés: 2010. július 2.)
- ↑ Wang Y (2001. March). „<146::AID-MED1004>3.0.CO;2-B The role and regulation of urokinase-type plasminogen activator receptor gene expression in cancer invasion and metastasis”. Medicinal Research Reviews 21 (2), 146–70. o. PMID 11223863. (Hozzáférés: 2010. július 2.)
- ↑ Danø K, Andreasen PA, Grøndahl-Hansen J, Kristensen P, Nielsen LS, Skriver L (1985). „Plasminogen activators, tissue degradation, and cancer”. Advances in Cancer Research 44, 139–266. o. PMID 2930999. (Hozzáférés: 2010. július 2.)
- ↑ Cantero D, Friess H, Deflorin J, et al. (1997). „Enhanced expression of urokinase plasminogen activator and its receptor in pancreatic carcinoma”. British Journal of Cancer 75 (3), 388–95. o. PMID 9020484. (Hozzáférés: 2010. július 2.)
- ↑ Bakkevold KE, Arnesjø B, Kambestad B (1992). „Carcinoma of the pancreas and papilla of Vater: presenting symptoms, signs, and diagnosis related to stage and tumour site. A prospective multicentre trial in 472 patients. Norwegian Pancreatic Cancer Trial” (angol nyelven). Scand. J. Gastroenterol. 27 (4), 317–25. o. DOI:10.3109/00365529209000081. PMID 1589710.
- ↑ a b c d e f The Comprehensive Center for Chronic Pancreatitis: Pancreatic Cancer Treatment; Diagnosis. University of Arizona, College of Medicine. [2010. július 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. szeptember 1.)
- ↑ a b c d e f g h Gaál 2007, pp. 857
- ↑ Pancreatic Cancer - Johns Hopkins Medicine: Surgical Treatment of Pancreatic Cancer. [2020. február 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. július 2.)
- ↑ a b c d e f g h i Gaál 2007, pp. 858
- ↑ Andrew H. Ko, MD: Cancer of the Pancreas. Cancer Supportive care Programs, 2008. március 19. [2010. február 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. szeptember 1.)
- ↑ a b Hruban, Von Hoff & Evans 2005, pp. 265-266
- ↑ a b c d e Pollock et al. 2004, p. 347
- ↑ a b c Gaál 2007, pp. 855
- ↑ Testini, M.; Regina, G.; Todisco, C.; Verzillo, F.; Di Venere, B.; Nacchiero, M. (1998). „An Unusual Complication Resulting from Surgical Treatment of Periampullary Tumours”. Panminerva Med 40 (3), 219–22. o. PMID 9785921.
- ↑ Michalski, C.W., Weitz, J.; Büchler, M.W.; others (2007). „Surgery Insight: Surgical Management of Pancreatic Ccancer”. Nature Clinical Practice Oncology 4 (9), 526–535. o. DOI:10.1038/ncponc0925. PMID 17728711.
- ↑ a b c d e Gaál 2007, pp. 859
- ↑ Carter R, Stocken DD, Ghaneh P, Bramhall SR, Olah A, Kelemen D, Bassi C, Friess H, Dervenis C, Spry N, Büchler MW, Neoptolemos JP (2009. June). „Longitudinal quality of life data can provide insights on the impact of adjuvant treatment for pancreatic cancer-Subset analysis of the ESPAC-1 data”. International Journal of Cancer. Journal International Du Cancer 124 (12), 2960–5. o. DOI:10.1002/ijc.24270. PMID 19330830. (Hozzáférés: 2010. szeptember 8.)
- ↑ Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, Schramm H, Fahlke J, Zuelke C, Burkart C, Gutberlet K, Kettner E, Schmalenberg H, Weigang-Koehler K, Bechstein WO, Niedergethmann M, Schmidt-Wolf I, Roll L, Doerken B, Riess H (2007. January). „Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial”. JAMA : the Journal of the American Medical Association 297 (3), 267–77. o. DOI:10.1001/jama.297.3.267. PMID 17227978. (Hozzáférés: 2010. szeptember 8.)
- ↑ Keserű dinnyével a hasnyálmirigyrák ellen[halott link] Magyar Nemzet 2013. március 19-i cikke.
- ↑ American Cancer Society: Can Cancer of the Pancreas Be Prevented? (angol nyelven). [2007. október 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. október 25.)
- ↑ Coughlin, SS, Calle EE, Patel AV, Thun MJ. (2000. December). „Predictors of pancreatic cancer mortality among a large cohort of United States adults” (angol nyelven). Cancer Causes Control. 11 (10), 915–23.. o. DOI:10.1023/A:1026580131793. PMID 11142526. (Hozzáférés: 2007. február 27.)
- ↑ Zheng, W, et al. (1993. September). „A cohort study of smoking, alcohol consumption, and dietary factors for pancreatic cancer (United States)”. Cancer Causes Control. 4 (5), 477–82.. o. DOI:10.1007/BF00050867. PMID 8218880. (Hozzáférés: 2007. február 27.)
- ↑ BBC NEWS | Health | Vitamin D 'slashes cancer risk'
- ↑ Vitamin D May Cut Pancreatic Cancer
- ↑ Archivált másolat. [2007. október 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. július 2.)
- ↑ Schernhammer E, Wolpin B, Rifai N, et al. (2007. June). „Plasma folate, vitamin B6, vitamin B12, and homocysteine and pancreatic cancer risk in four large cohorts” (angol nyelven). Cancer Res. 67 (11), 5553–60. o. DOI:10.1158/0008-5472.CAN-06-4463. PMID 17545639.
- ↑ United Press International - Consumer Health Daily - Briefing. [2009. február 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. június 4.)
Források[szerkesztés]
- Kopper László, Schaff Zsuzsa , Illyés György. 18. A pancreas patológiája, Patológia 1-2, 2, Budapest: Medicina Könyvkiadó Zrt (2006). ISBN 9632260759
- Gaál, Csaba. Sebészet, 6, MEDICINA KÖNYVKIADÓ zRT. (2007). ISBN 9789632260358
- Peter W. T. Pisters; Evans, Douglas; Brennan, Murray F; James L. Abbruzzese; Eileen O'Reilly. Pancreatic cancer (angol nyelven). Berlin: Springer (2002). ISBN 0-387-95185-7
- Yamada, Tadataka. 47., E PANCREAS, Atlas of Gastroenterology, negyedik kiadás (angol nyelven), Wiley-Blackwell (2009). ISBN 1-4051-6909-5
- David Lowell Strayer; Raphael Rubin; Rubin, Emanuel. 15, The Pancreas: Pancreatic Cancer, Rubin's pathology: clinicopathologic foundations of medicine, Ötödik, bővített kiadás (angol nyelven), Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins (2008). ISBN 0-7817-9516-8
- McPhee, Stephen J.. Pathophysiology of disease: an introduction to clinical medicine (angol nyelven). Norwalk, CT: Appleton & Lange (1997). ISBN 0-8385-7678-8
- Akimasa Nakao; Pollock, Raphael E.; James H. Doroshow; Khayat, David. UICC manual of clinical oncology, 8, New York: Wiley (2004). ISBN 0-471-22289-5
- Hruban, Ralph H.; Von Hoff, Daniel D.; Evans, Douglas. Pancreatic cancer. Boston: Jones and Bartlett Publishers, 265-266. o. (2005). ISBN 0-7637-2178-6
További információk[szerkesztés]
- The Johns Hopkins Pancreatic Cancer Web Site
- Pancreatic Cancer Action Network (PanCAN)
- The Pancreatic Society of Great Britain and Ireland
- The Johns Hopkins Pancreatic Cancer Web Site Discussion Board
- Rare Pancreatic & Neuroendocrine Cancer Support
- Pancreatic Cancer UK
- Confronting Pancreatic Cancer (Pancreatica.org)
- Cancer of the Pancreas (Cancer Supportive Care Program)
- American Cancer Society: Detailed Guide on Pancreatic Cancer Archiválva 2010. június 27-i dátummal a Wayback Machine-ben
- The National Familial Pancreas Tumor Registry
- Pancreatic Cancer Collaborative Registry (PCCR)
- The Lustgarten Foundation For Pancreatic Cancer Research
- Hasnyálmirigyrák műtét Whipple módszerével (Videó)
- MedlinePlus
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |